题目内容
1.对工业废水和生活污水进行处理是防止水体污染的主要措施.Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如图:
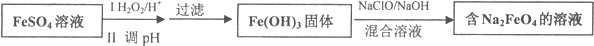
(1)假设每步反应均是完全的,若制取3mol Na2FeO4,需要NaClO固体335.25g.
(2)写出第一步在酸性环境下加入H2O2的离子反应方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)石灰纯碱法是常用的硬水软化方法,已知25℃时Ksp(CaCO3)=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5mol•L-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为2×10-4mol/L.
分析 (1)根据氧化还原反应方程式来计算;
(2)H202在酸性条件下能将Fe2+氧化为Fe3+,H202被还原为水,据此写出离子方程式;
(3)Na2CO3溶液的浓度为2.8×10-5mol/L,等体积混合后溶液中c(CO32-)=1.4×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),以此来解答.
解答 解(1)由Fe(0H)3制取Na2FeO4的化学方程式为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,设需要的NaClO的物质的量为Xmol,
则有:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O
3 2
Xmol 3mol
解得X=4.5mol
则NaClO的质量m=nM=4.5mol×74.5g/mol=335.25g
故答案为:335.25;
(2)H202在酸性条件下能将Fe2+氧化为Fe3+,H202被还原为水,故离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)Na2CO3溶液的浓度为5.6×10-5mol/L,等体积混合后溶液中c(CO32-)=×5.6×10-5mol/L=2.8×10-5mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=mol/L=1×10-4mol/L,原溶液Ca(OH)2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液Ca(OH)2溶液的最小浓度为2×1×10-4mol/L=2×10-4mol/L,
故答案为:2×10-4mol/L.
点评 本题考查较综合,涉及氧化还原反应及应用等,注重高频考点的考查,综合性较强,题目难度较大,注意化学与生活的联系.

 阅读快车系列答案
阅读快车系列答案| A. | 煤的液化和气化都是化学变化 | |
| B. | 硝化反应和酯化反应都属于取代反应 | |
| C. | 石油的分馏和裂化都是化学反应 | |
| D. | 乙烯与溴和水的反应都属于加成反应 |
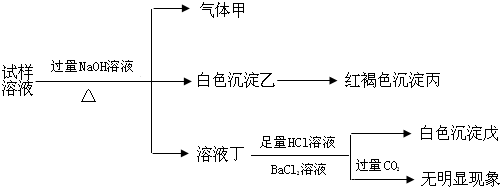
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正<V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ∕mol
(4)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg则该混合物样品中Na2CO3的质量分数是$\frac{31a-84b}{31a}$.
(5)钠一钾合金可在核反应堆中用作热交换液.5.05g钠一钾合金溶于200mL水生成0.075mol氢气,则该溶液中氢氧根离子的物质的量浓度是0.75mol/L(忽略溶液体积变化).
| A. | 常温下,pH=7的NH4Cl和NH3•H2O的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Cu2+ | |
| B. | 在pH=1的溶液中:Fe2+、Mg2+、NO3-、ClO- | |
| C. | c(H+)=10-12 mol•L-1的溶液:Na+、S2-、AlO2-、SO32- | |
| D. | 使石蕊试液变红的溶液:K+、NH4+、I-、MnO4- |
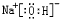 、
、 .
.
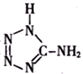 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.