题目内容
19.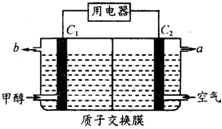 燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )| A. | b口放出气体为CO2 | |
| B. | 质子将由C1电极区经交换膜向C2电极区运动 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3 molCu | |
| D. | 电池总反应的产物与甲醇燃烧产物一样 |
分析 该燃料电池中电解质溶液呈酸性,通入燃料甲醇的电极C1是负极,通入空气的电极C2是正极,
A.负极上甲醇失电子生成二氧化碳和氢离子;
B.C1是负极,C2是正极,电解质溶液中质子从负极流向正极;
C.根据转移电子相等进行计算;
D.燃料电池总反应是燃料燃烧的化学方程式,在酸性介质下,甲醇燃料电池的总反应产物与甲醇燃烧产物一样.
解答 解:该燃料电池中电解质溶液呈酸性,通入燃料甲醇的电极C1是负极,通入空气的电极C2是正极,
A.负极上甲醇失电子生成二氧化碳和氢离子,所以b口放出气体为CO2,故A正确;
B.C1是负极,C2是正极,电解质溶液中质子从负极流向正极,所以质子将由C1电极区经交换膜向C2电极区运动,故B正确;
C.燃料电池总反应是:2CH4O+3O2=2CO2+4H2O,当消耗1mol甲醇时,转移电子是6mol,用该电池电解精制铜,可根据主反应:Cu-2e-=Cu2+,转移电子是6mol,溶解粗铜中3mol铜,但是阳极上先是活泼金属失电子,然后是金属铜失电子,所以当消耗1mol甲醇时,可溶解粗铜中铜的量小于3mol,故C错误;
D.燃料电池总反应是燃料燃烧的化学方程式,在酸性介质下,甲醇燃料电池的总反应产物与甲醇燃烧产物一样,故D正确;
故选C.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应是解本题关键,易错选项是C,注意粗铜精炼中阳极上不仅铜失电子,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
9.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
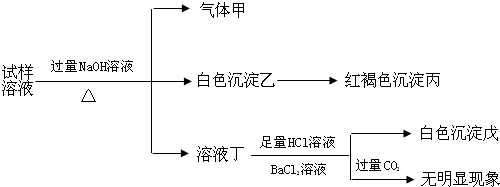
根据以上的实验操作与现象,该同学得出的结论不正确的是( )

根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定有NH4+、SO42-和Fe2+ | |
| B. | 试样中一定没有Al3+ | |
| C. | 若气体甲在标准状况下体积为0.448L,沉淀丙和沉淀戊分别为1.07g和4.66g,则可判断溶液中还有Cl- | |
| D. | 该盐工业上可以用作净水剂 |
14.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是( )
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
4.可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极.下列说法正确的是( )
| A. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-═4OH- | |
| B. | 以NaOH溶液为电解液时,负极区域的现象:先生成白色沉淀后逐渐溶解 | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
11.在下列溶液中一定能够大量共存的离子组是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Cu2+ | |
| B. | 在pH=1的溶液中:Fe2+、Mg2+、NO3-、ClO- | |
| C. | c(H+)=10-12 mol•L-1的溶液:Na+、S2-、AlO2-、SO32- | |
| D. | 使石蕊试液变红的溶液:K+、NH4+、I-、MnO4- |
8.下列物质的分类正确的是( )
| A. | Na2O、MgO、Al2O3都是碱性氧化物 | |
| B. | 硬铝、黄铜、钢铁都属于合金 | |
| C. | 纤维素、硝化纤维、纤维二糖都是高分子 | |
| D. | 蔗糖、乙醇、液氯都是非电解质 |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.