题目内容
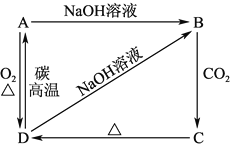
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转换关系 (部分反应中得水已忽略)

(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为____________________________________________;
②氯碱工业制备A的化学方程式是__________________________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是____________________________________________;
②A的实验制法的化学方程式____________________________________________。
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式____________________________________。
【答案】2OH-+CO2 =CO32-+H2O 2NaCl+2H2O ![]() 2NaOH + Cl2↑+ H2↑FeCl3水解生成Fe(OH)3胶体,可吸附水中杂质MnO2 + 4HCl(浓)
2NaOH + Cl2↑+ H2↑FeCl3水解生成Fe(OH)3胶体,可吸附水中杂质MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓
MnCl2 + Cl2↑ + 2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓
【解析】
(1)若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性;(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2。
(1)若A为氯碱工业的产品,C为厨房中的用品,可知A为NaOH,C为NaHCO3,B为Na2CO3,D为CO2,Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,
①反应Ⅰ为NaOH和少量CO2的反应,反应的离子方程式是2OH-+CO2 =CO32-+H2O;②氯碱工业制备A,即NaOH时,电解饱和食盐水生成氢氧化钠、氯气和氢气,反应的化学方程式是2NaCl+2H2O ![]() 2NaOH + Cl2↑+ H2↑;(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2,B为FeCl3,FeCl3水解生成Fe(OH)3胶体,可吸附水中杂质,可用于净水;
2NaOH + Cl2↑+ H2↑;(2)D元素的一种红棕色氧化物常用作颜料,应为氧化铁,则D为Fe,A为Cl2,B为FeCl3,C为FeCl2,B为FeCl3,FeCl3水解生成Fe(OH)3胶体,可吸附水中杂质,可用于净水;
②A为Cl2,实验室利用加热二氧化锰和浓盐酸反应生成氯化锰、氯气和水的方法得到氯气,反应的化学方程式为MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O;(3)若B是一种两性氢氧化物则为氢氧化铝,反应Ⅲ是偏铝酸盐与铝盐发生双水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。
MnCl2 + Cl2↑ + 2H2O;(3)若B是一种两性氢氧化物则为氢氧化铝,反应Ⅲ是偏铝酸盐与铝盐发生双水解反应生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓。

 口算能手系列答案
口算能手系列答案【题目】现有部分元素的原子结构特点如表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图________________________。
(2)元素X与元素Z相比,非金属性较强的是________(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:________________________________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为____________________。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式________。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:____________________________________。