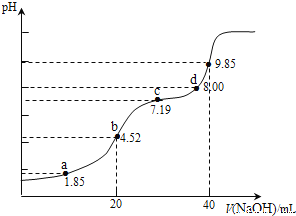
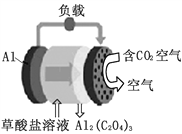
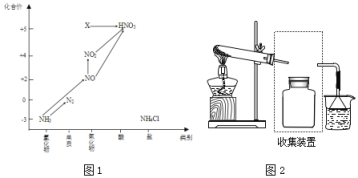
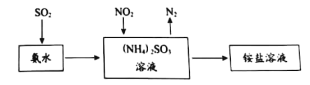
题目内容
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
2H+(aq)+2CrO42-(aq,黄色),现进行如下实验:①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量;②向①所得溶液中滴加1mol/LHNO3溶液至稍过量。下列分析不正确的是
A. 上述反应平衡常数的表达式为:K=[c(H+)·c2(CrO42-)]/[c(Cr2O72-)·c(H2O)]
B. 实验①现象:溶液由橙色变为黄色,实验②现象:溶液由黄色变为橙色
C. 实验①和②的目的是探究H+浓度对上述平衡的影响
D. 预测稀释K2Cr2O7溶液时,溶液颜色由橙色变为黄色
【答案】A
【解析】A.平衡常数等于生成物浓度幂之积比上反应物浓度幂之积,水的浓度是常数,所以K=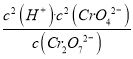 ,故A错误;B. 实验①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量,Cr2O72-(aq,橙色)+H2O(l)
,故A错误;B. 实验①向试管中加入4mL0.1mol/LK2Cr2O7溶液,再滴加1mol/LNaOH溶液至稍过量,Cr2O72-(aq,橙色)+H2O(l)![]() 2H+(aq)+2CrO42-(aq,黄色),平衡正向移动,溶液由橙色变为黄色,实验②向①所得溶液中滴加1mol/LHNO3溶液至稍过量,平衡又逆向移动,溶液由黄色变为橙色,故B正确;C. 根据实验①和②加入试剂改变了溶液中氢离子的浓度,因此目的是探究H+浓度对上述平衡的影响,故C正确;D. 稀释K2Cr2O7溶液时,平衡正向移动,溶液颜色由橙色变为黄色,故D正确;故选A。
2H+(aq)+2CrO42-(aq,黄色),平衡正向移动,溶液由橙色变为黄色,实验②向①所得溶液中滴加1mol/LHNO3溶液至稍过量,平衡又逆向移动,溶液由黄色变为橙色,故B正确;C. 根据实验①和②加入试剂改变了溶液中氢离子的浓度,因此目的是探究H+浓度对上述平衡的影响,故C正确;D. 稀释K2Cr2O7溶液时,平衡正向移动,溶液颜色由橙色变为黄色,故D正确;故选A。

练习册系列答案
相关题目