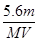题目内容
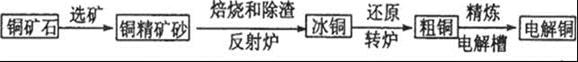
某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:

已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
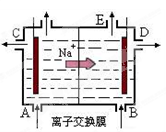
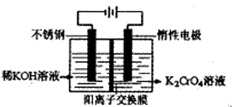
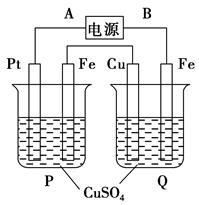
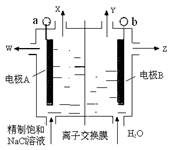
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:
电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比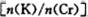 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。

已知:①
 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:

回答下列问题:
(1)滤渣的成分是 。(写化学式)
(2)写出第③步反应的离子方程式 。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有 。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:

电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比
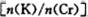 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。(1)Cr(OH)3、Fe(OH)3、Cu(OH)2(3分)
(2)2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O(2分)
(3)漏斗、烧杯、玻璃棒(3分)
(4)2-d(2分)
(2)2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O(2分)
(3)漏斗、烧杯、玻璃棒(3分)
(4)2-d(2分)
试题分析:(1)由题干所给信息可知在pH=8.0~9.5时,Cr3+、Fe3+、Cu2+均转化为相应氢氧化物沉淀,因此利用流程可知滤渣的成分为Cr(OH)3、Fe(OH)3、Cu(OH)2。(2)在第③步中+3价Cr被氧化为+6价Cr,因此H2O2被还原,结合溶液为碱性和电荷守恒等可写出反应的离子方程式。(3)调节pH=13时,Cr(OH)3溶解,而Fe(OH)3、Cu(OH)2仍为固体,因此可通过过滤操作分离出[Cr(OH)4]-,过滤操作所需玻璃仪器有玻璃棒、烧杯、漏斗。(4)由电解图示知电解时,阳极室发生反应为4OH--4e-=O2↑+2H2O,导致溶液中c(H+)增大,促使2CrO42- +2H+
 Cr2O72-+H2O向右进行,同时K+移向阴极,因此可推知阳极室中CrO42-转化的物质的量等于电路中通过电子的物质的量,等于移向阴极K+的物质的量;而由原子守恒知电解前阳极液中n(K)/n(Cr)=2,电解后阳极液中n(K)/n(Cr)=d,故电解后阳极室中减少的n(K+)=n(Cr)转化=(2-d)×nCr,因此铬酸钾的转化率等于(2-d)×n(Cr)÷n(Cr)=2-d。
Cr2O72-+H2O向右进行,同时K+移向阴极,因此可推知阳极室中CrO42-转化的物质的量等于电路中通过电子的物质的量,等于移向阴极K+的物质的量;而由原子守恒知电解前阳极液中n(K)/n(Cr)=2,电解后阳极液中n(K)/n(Cr)=d,故电解后阳极室中减少的n(K+)=n(Cr)转化=(2-d)×nCr,因此铬酸钾的转化率等于(2-d)×n(Cr)÷n(Cr)=2-d。
练习册系列答案
相关题目
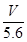 mol
mol