题目内容
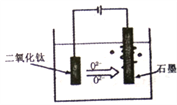
【题目】下列有关金属电化学腐蚀的说法正确的是( )
A. 铜既可以发生析氢腐蚀也可以发生吸氧腐蚀
B. 牺牲阳极的阴极保护法中被保护的金属应做负极
C. 外加电流阴极保护法中被保护的金属应与电源的负极相连
D. 析氢腐蚀比吸氧腐蚀普遍
【答案】C
【解析】
A. 铜不能与酸反应置换出氢气,则不可以发生析氢腐蚀,A错误;
B. 牺牲阳极的阴极保护法中被保护的金属应做正极,B错误;
C. 外加电流阴极保护法中被保护的金属应与电源的负极相连,则电池的负极提供电子,金属被保护,C正确;
D. 金属在潮湿的环境中与氧气接触,易发生吸氧腐蚀,则吸氧腐蚀比析氢腐蚀普遍,D错误;
答案为C。

【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
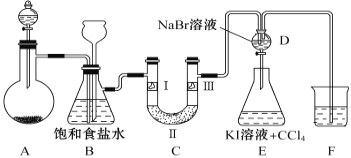
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。