题目内容
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式_______。
(2)Li2Ti5O15中过氧键的数目为4,其中Ti的化合价为______。
(3)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe2+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时_____(填“有”或“无”)Mg3(PO4)2沉淀生成。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-2、1.0×10-2。
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_________。
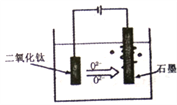
(5)TiO2·xH2O加热制得的粗TiO2是电解法生产金属钛的一种较先进的方法,电解液为某种可传导02-离子的熔融盐,原理如图所示,则其阴极电极反应为:_______,电解过程中阳极电极上会有气体生成,该气体可能含有____________。
【答案】 FeTiO3+ 4H++4Cl = Fe2++ TiOCl42 + 2H2O +4 无 2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑ TiO2+4e-=Ti+2O2- O2、CO、CO2
2LiFePO4+ H2O↑+ 3CO2↑ TiO2+4e-=Ti+2O2- O2、CO、CO2
【解析】(1)“酸浸”后,钛主要以TiOCl42-形式存在,相应反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,故答案为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O;
(2)Li2Ti5O15中Li的化合价为+1,有4个过氧键,说明有8个O原子的化合价为-1,7个O原子的化合价为-2,由化合价的代数和为0可知,,Ti元素的化合价之和为20,所以Ti的化合价为+4,故答案为:+4。
(3)Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5,由Ksp(FePO4),可知![]() ,
,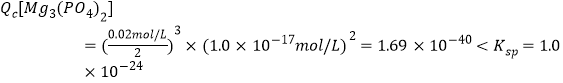
故没有沉淀生成。
(4)高温煅烧②”中由FePO4制备LiFePO4的化学方程式为2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑
2LiFePO4+ H2O↑+ 3CO2↑
(5)电解时,阴极发生还原反应生成Ti,电极方程式为TiO2+4e-=Ti+2O2-,阳极发生氧化反应,电极方程式为2O2-+4e-=O2,阳极生成O2,由于阳极材料为石墨,则氧气和石墨反应可生成CO、CO2等,故答案为:TiO2+4e-=Ti+2O2-;O2、CO、CO2。

【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
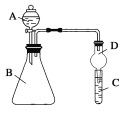
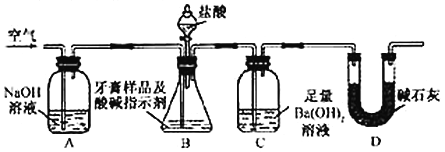
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2)]是分析化学中的重要试剂,在隔绝空气加热至500℃时能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。某化学小组选用下图所示装置进行实验(夹持装置略),探究此反应产物。

(1)甲同学根据可能生成的气体产物,设计下列实验:
操作步骤 | 实验现象 | 结论或解释 |
①按______________的顺序组装仪器并进行实验 | ②___________ | 气体产物中既有H2O ,也有NH3 |
③按A、C、D、E的顺序组装仪器并进行实验,其中装置C的作用是____________ | C中无明显现象,D中生成白色沉淀 | ④D中发生反应的离子方程式为___________ |
(2)乙同学称取14.20g硫酸亚铁铵固体,隔绝空气加热至500℃ 时使其完全分解,冷却后称得固体质量为4.00g,则所得固体产物的化学式为_____。(硫酸亚铁铵的摩尔质量为284g·mol-1)
(3)实验证明:(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2生成,写出硫酸亚铁铵在隔绝空气的条件下加热至500℃时的分解反应方程式_____________________________________。