题目内容
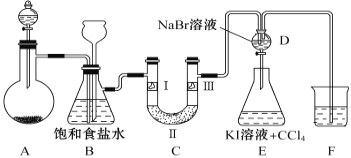
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成一段水柱,锥形瓶内液面下降 D NaOH溶液 E中溶液分为两层,下层(四氯化碳层)液体为紫红色 不能
MnCl2+Cl2↑+2H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成一段水柱,锥形瓶内液面下降 D NaOH溶液 E中溶液分为两层,下层(四氯化碳层)液体为紫红色 不能
【解析】
二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,由于浓盐酸易挥发,制备的氯气中含有氯化氢,饱和食盐水可以除去氯化氢;装置C可以验证氯气是否具有漂白性,选用验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;氯气有毒,直接排放容易引起空气污染,选用用氢氧化钠溶液吸收,据此分析解答。
(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;装置B也是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的,压强增大,气体将溶液压入长颈漏斗B中,形成水柱,故答案为:除去Cl2中的HCl; B中长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中AB的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;C中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故选D;
(4)氯气有毒,直接排放容易引起空气污染,氯气能够与氢氧化钠反应生成氯钠、次氯酸钠和水,离子方程式:2OH-+Cl2=Cl-+ClO-+H2O,可以用氢氧化钠溶液吸收过量的氯气,故答案为:NaOH溶液;
(5)打开活塞,将装置D中含溴单质的少量溶液加入焓碘化钾和苯的装置E中,溴单质和碘化钾反应生成碘单质,碘单质溶于四氯化碳呈紫红色,振荡。观察到的现象是:E中溶液分为两层,下层(四氯化碳层)液体为紫红色,此现象不能说明溴的氧化性大于碘,因为过量的氯气也会氧化碘离子为碘单质,故答案为:E中溶液分为两层,下层(四氯化碳层)液体为紫红色;不能。

 口算题天天练系列答案
口算题天天练系列答案【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl、NH4+、Mg2+、CO32、Ba2+、SO42。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行三组实验,实验内容和结果如下表所示:
实验序号 | 实验内容 | 实验结果 |
1 | 加AgNO3溶液 | 有白色沉淀生成 |
2 | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准状况下的体积) |
3 | 加入足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后对剩余沉淀进行洗涤、干燥、称量 | 第一次称量读数为6.27g 第二次称量读数为2.33g |
根据实验判断,下列说法正确的是( )
A. 该溶液中一定含有的阳离子是K+、NH4+
B. 该溶液中一定不含的离子是Ba2+、Mg2+、Cl
C. 无法确定是否含有的离子是K+、Cl
D. 向实验3所得沉淀中加入盐酸时所发生反应的离子方程式为CO32 + 2H+ = H2O + CO2↑
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)这九种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____________。
(2)④、⑤、⑧三种元素中,离子半径由大到小的顺序为__________(填离子符号)。
(3)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
⑧和⑨元素的气态氢化物稳定性顺序为_____________________(填化学式)。
(4)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为____________________________。
(5)①、④、⑤、⑨四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式____________。
(6)元素⑤与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与②的最高价氧化物反应的化学方程式为_____________,②的最高价氧化物的电子式___________。
(7)能说明⑧的非金属性比⑨的非金属性__________(填“强”或“弱”)的事实是________(用离子方程式说明)。
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2)]是分析化学中的重要试剂,在隔绝空气加热至500℃时能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。某化学小组选用下图所示装置进行实验(夹持装置略),探究此反应产物。

(1)甲同学根据可能生成的气体产物,设计下列实验:
操作步骤 | 实验现象 | 结论或解释 |
①按______________的顺序组装仪器并进行实验 | ②___________ | 气体产物中既有H2O ,也有NH3 |
③按A、C、D、E的顺序组装仪器并进行实验,其中装置C的作用是____________ | C中无明显现象,D中生成白色沉淀 | ④D中发生反应的离子方程式为___________ |
(2)乙同学称取14.20g硫酸亚铁铵固体,隔绝空气加热至500℃ 时使其完全分解,冷却后称得固体质量为4.00g,则所得固体产物的化学式为_____。(硫酸亚铁铵的摩尔质量为284g·mol-1)
(3)实验证明:(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2生成,写出硫酸亚铁铵在隔绝空气的条件下加热至500℃时的分解反应方程式_____________________________________。
【题目】下面是元素周期表的一部分,请按要求填空:
A | C | ||||||||||||||||
B | D | E | |||||||||||||||
F | |||||||||||||||||
(1)A元素最高价氧化物的化学式为_______。
(2)单质A与C在放电时形成的化合物为________(填化学式)。
(3)F、E元素最高价氧化物对应的水化物酸性比较:_____(填化学式)。
(4)B在C中燃烧形成的化合物电子式:____________________。
(5)化合物FE的化学性质与卤素的性质相似,可与水发生反应生成卤化氢和次卤酸。试写出FE与水发生反应的化学方程式__________________________。