题目内容
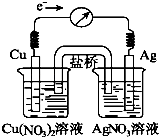
【题目】2L容器中,分别将物质的量均为2.00mol的SO2、O2混合,在不同温度(T)下发生如下反应:2SO2(g)+O2(g)2SO3(g).并在第10s时分别测定其中SO3的体积分数(SO3%)并绘成如图所示曲线:则下列说法正确的是( ) 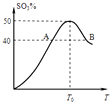
A.此反应的正反应为吸热反应
B.A,B两点正反应速率的大小关系是:vA>vB
C.以O2表示T0对应的平均反应速率 ![]() (O2)=0.04 mol/(L?s)
(O2)=0.04 mol/(L?s)
D.温度T<T0时,温度升高,平衡向正反应方向移动,所以SO3%逐渐增大
【答案】C
【解析】解:A、由图象得随着温度的继续升高(T0时达平衡状态),SO3%的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,故A错误;B、温度越高反应速率越大,所以A、B两点正反应速率关系vA<vB , 故B错误;
C、设参加反应的氧气为xmol
2X(g)+ | Y(g) | 2W(g) | ||
起始的量: | 2mol | 2mol | 0 | |
转化的量: | 2x | x | 2x | |
平衡的量: | 2﹣2x | 2﹣x | 2x |
T0SO3%的物质的量分数为50%,所以 ![]() ×100%=50%,所以x=0.8mol,则v(O2)=
×100%=50%,所以x=0.8mol,则v(O2)= ![]() =
= ![]() =0.04 mol/(Ls),故C正确;
=0.04 mol/(Ls),故C正确;
D、随着温度的升高,反应向正反应方向进行,当温度达到T0时,SO3%的物质的量分数最大,说明达到反应的最大限度,即平衡状态,温度T<T0时,反应一直向正反应方向进行,不能说明温度升高,平衡向正反应方向移动,故D错误;
故选:C.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目