��Ŀ����
����Ŀ������ӦCu��s��+2Ag+��aq��Cu2+��aq��+2Ag��s����Ƴ�ԭ��أ�ijһʱ�̵ĵ�����������
A.ָ��ƫת������ͼ��ʾ���й�������ȷ���ǣ� �� 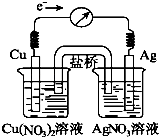
B.KNO3�����е�K+����Cu��NO3��2��Һ
C.��������ָ��ָ��0ʱ���÷�Ӧ��ƽ�⣬ƽ�ⳣ��K=0
D.������������Һ�м���NaCl���壬����NaCl�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת
E.������ͭ��Һ�м���NaOH���壬����NaOH�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת
���𰸡�C
���������⣺A����ԭ����У�ͭ�������������������ŵ�ʱ��������еļ���������������Һ�ƶ�����A����B����������ָ��Ϊ0ʱ���÷�Ӧ��ƽ��״̬����ƽ�ⳣ��K������0����B����
C����AgNO3aq�м���NaCl���壨������Ժ���ϡ��Ӱ�죩��Cl������Һ�е�Ag+�γ�AgCl������������Һ��ϵ��c��Ag+����С���� ![]() �ӽ�K����Ӧ�ٶȼ�С����ָ������ƫת���ȼ�С��c��Ag+��������С����
�ӽ�K����Ӧ�ٶȼ�С����ָ������ƫת���ȼ�С��c��Ag+��������С���� ![]() ����K����Ӧ�ٶ�Ϊ0����ָ��ָ��0��c��Ag+��������С����
����K����Ӧ�ٶ�Ϊ0����ָ��ָ��0��c��Ag+��������С���� ![]() ��K����Ӧ��Ϊ�淽����У���ָ������ƫת����������NaCl�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת����C��ȷ��
��K����Ӧ��Ϊ�淽����У���ָ������ƫת����������NaCl�������ӣ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת����C��ȷ��
D����Cu��NO3��2��Һ�м���NaOH���壬�������ƺ�����ͭ��Ӧ����������ͭ����������NaOH�������ӣ��� ![]() �ӽ���ѧƽ�ⳣ��K��ʱ����Ӧ���ʼ�С��ָ������ƫת���ȼ�С����
�ӽ���ѧƽ�ⳣ��K��ʱ����Ӧ���ʼ�С��ָ������ƫת���ȼ�С���� ![]() ���ڻ�ѧƽ�ⳣ��K��ʱ��ָ��Ϊ0����
���ڻ�ѧƽ�ⳣ��K��ʱ��ָ��Ϊ0���� ![]() С�ڻ�ѧƽ�ⳣ��K��ʱ��ָ������ƫת����������NaOH��������ָ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת����D����
С�ڻ�ѧƽ�ⳣ��K��ʱ��ָ������ƫת����������NaOH��������ָ�������ָ������ƫת���ȼ�С��ָ��ָ��0������ƫת����D����
��ѡC��