题目内容
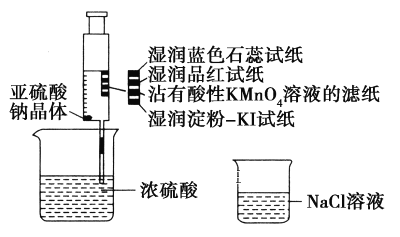
【题目】在如图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有适量铜片和过量硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
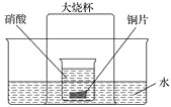
(1)实验过程中,观察到的主要现象是:
①____________________;
②_____________;
③________________;
④_____________________。
(2)用该装置做铜与浓硝酸反应的实验,最突出的特点是:_____________________。
(3)若要验证最终得到的气体生成物,最简便的方法是_______________。
(4)工业上吸收NO和NO2的混合气体,常使用NaOH溶液(NO+NO2+2NaOH===2NaNO2+H2O)。欲使NO和NO2被充分吸收,则NO和NO2的体积应满足________。
A V(NO)>V(NO2)
B V(NO)<V(NO2)
C V(NO)≤V(NO2)
【答案】铜片表面产生气泡,铜片慢慢溶解并逐渐消失 小烧杯中溶液的颜色逐渐变成蓝色 大烧杯中有红棕色气体生成,后来慢慢变成无色 大烧杯内液面上升,水槽中液面下降 反应体系封闭,无氮氧化物逸出,不污染环境 轻轻掀起倒扣的大烧杯,通入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体 C
【解析】
铜与浓硝酸剧烈反应生成硝酸铜、二氧化氮和水,反应生成的红棕色二氧化氮与水反应生成硝酸和无色气体一氧化氮,一氧化氮被烧杯中少量空气中的氧气氧化生成二氧化氮,二氧化氮又与水反应生成一氧化氮。
(1)小烧杯中,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,铜片逐渐溶解,硝酸铜溶液呈蓝色,有红棕色的NO2气体产生,接着NO2和烧杯中的O2、H2O发生反应4NO2+O2+2H2O=4HNO3,若O2消耗完,则发生反应3NO2+H2O=2HNO3+NO,故气体颜色慢慢变成无色,由于烧杯中的气体减少,故大烧杯内液面上升,水槽中液面下降,故答案为:铜片表面产生气泡,铜片慢慢溶解并逐渐消失;小烧杯中溶液的颜色逐渐变成蓝色;大烧杯中有红棕色气体生成,后来慢慢变成无色;大烧杯内液面上升,水槽中液面下降;
(2) NO2和NO是有毒气体,逸出会污染环境,该反应体系密闭,反应产生的NO2和NO不会逸出,不污染环境,故答案为:反应体系封闭,无氮氧化物逸出,不污染环境;
(3) 无色的NO能与O2反应生成红棕色的NO2,轻轻掀起倒扣的大烧杯,通入适量的空气,若气体颜色变为红棕色,说明有一氧化氮生成,故答案为:轻轻掀起倒扣的大烧杯,通入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体;
(4)由方程式NO+NO2+2NaOH=2NaNO2+H2O可知,当NO和NO2的体积相等时,可以完全被吸收;若NO2有剩余,则NO2和NaOH溶液发生反应:2NO2+2NaOH=NaNO3+NaNO2+H2O,故欲使NO和NO2被充分吸收,需满足V(NO)≤V(NO2),故答案为:C。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案