题目内容
(14分)
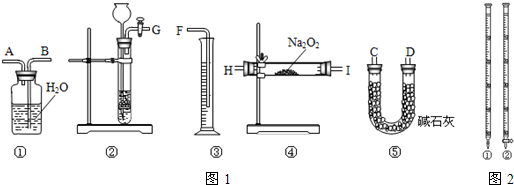
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
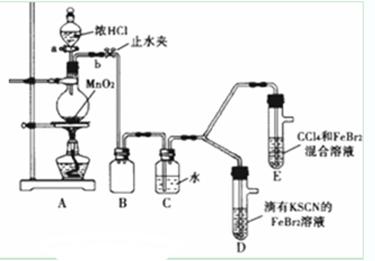
(1) ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2) 用改正后的装置进行实验.实验过程如下:
(3) 因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深最后变成红色。为探究上述实验现象的本质,小组同学查得资料如下:
① 请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因___________________,请设计简单实验证明上述解释:______________________
② 欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因_______________________________________________
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为:___________________
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:

(1) ①检查气体发生装置A的气密性的操作是:____________
②整套实验装置存在一处明显不足,请指出_____________.
(2) 用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ______________________ |
D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深最后变成红色。为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
② 欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因_______________________________________________
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为:___________________
(1)①关闭活塞A,打开止水夹B,将长导管末端浸入水中,用手捂住圆底烧瓶,管口有气泡产生;松开手后,有水进入导管,则气密性良好。②缺少尾气处理装置。
(2)Cl2> Br2 > Fe3+
(3)①过量氯气和SCN-反应:2SCN-+Cl2=2Cl+(SCN)2,,使SCN- 浓度减小,则使Fe3+
+3SCN- ="=" Fe(SCN)3平衡向逆反应方向移动而褪色。
检验方法为:取少量褪色后的溶液,滴加KSCN 溶液,若溶液变红色,则上述推理合理;或取少量褪色后的溶液,滴加Fe Cl3溶液,若溶液不变红,则上述推理合理
②BrCl+H2O=HBrO反应产生 Cl-由于AgBrO易溶于水,加入 AgNO3溶液,只能生成AgNO3沉淀
③BrCl+2KI=KCl+KBr+I2
(2)Cl2> Br2 > Fe3+
(3)①过量氯气和SCN-反应:2SCN-+Cl2=2Cl+(SCN)2,,使SCN- 浓度减小,则使Fe3+
+3SCN- ="=" Fe(SCN)3平衡向逆反应方向移动而褪色。
检验方法为:取少量褪色后的溶液,滴加KSCN 溶液,若溶液变红色,则上述推理合理;或取少量褪色后的溶液,滴加Fe Cl3溶液,若溶液不变红,则上述推理合理
②BrCl+H2O=HBrO反应产生 Cl-由于AgBrO易溶于水,加入 AgNO3溶液,只能生成AgNO3沉淀
③BrCl+2KI=KCl+KBr+I2
试题分析:(1) ②氯气有毒不能直接排空,且如果氯气有剩余会导致D和E装置中气体压强增大,导致安全事故的发生,所以该实验装置的缺点为:缺少尾气处理装置。
(2)D装置中:溶液变红,说明有铁离子生成,据此得出氯气的氧化性大于铁离子;
E装置中:水层溶液变黄,振荡后CCl4层无明显变化,说明氯气和溴离子不反应,
根据D和E装置知,溴的氧化性大于铁离子,则氧化性强弱顺序是 Cl2>Br2>Fe3+,

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目