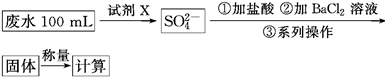
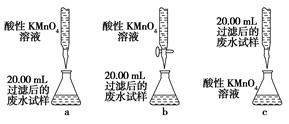
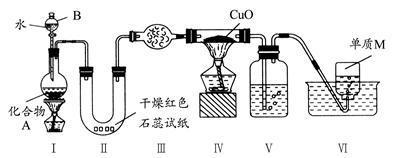
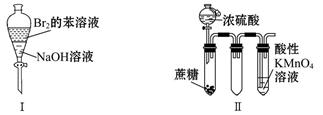
题目内容
根据下列实验现象,所得结论正确的是( )
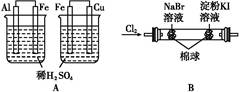
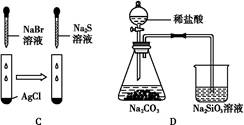


| 实验 | 实验现象 | 结论 |
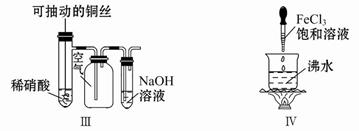
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 金属活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A
活泼的金属作负极,失电子,较不活泼的金属作正极,H+在正极得电子析出氢气,所以金属活动性:Al>Fe>Cu,A正确;B中只能得出氧化性:Cl2>Br2;Cl2>I2,不能比较Br2与I2的氧化性,B错误;C中发生了沉淀的转化,溶解性大的难溶物转化为溶解性小的难溶物,所以得到结论为:溶解性:AgCl>AgBr>Ag2S,C错;利用酸性强弱比较非金属的非金属性强弱时只能是其最高价含氧酸,这里用盐酸,不能得出相应的结论,D错。

练习册系列答案
相关题目
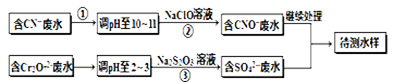
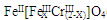 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 。