题目内容
下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
B
试题分析:A、溴乙烷在氢氧化钠的溶液中加热发生水解生成乙醇、溴化钠。在酸性条件下溴化钠与硝酸银溶液反应产生淡黄色沉淀溴化银,能达到实验目的,A正确;B、在酸性条件下,NO3-具有氧化性,能把Fe2+氧化生成铁离子,铁离子与KSCN溶液发生显色反应,溶液显红色,不能达到实验目的,B不正确;C、下层液体呈紫色,说明反应中有碘生成,即溴与碘化钾发生了置换反应生成了碘和溴化钾,这说明溴的氧化性强于碘的氧化性,C正确;D、将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色,说明反应中有氢氧化铁生成。根据沉淀容易向更难溶的方向转化可知Fe(OH)3的溶解度小于Mg(OH)2的溶解度,D正确,答案选B。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
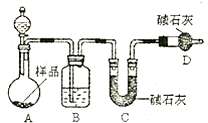
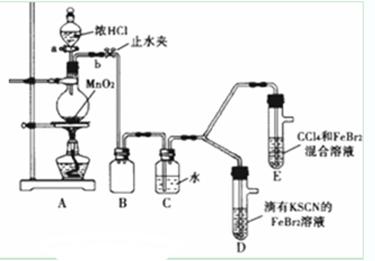
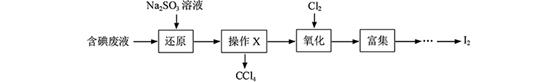
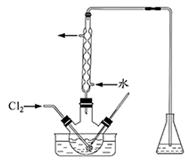
 I2+5SO42—+H2O
I2+5SO42—+H2O