题目内容
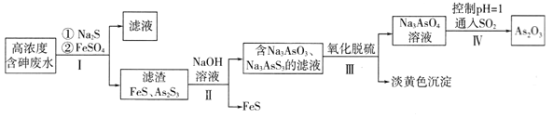
【题目】利用高浓度含砷废水(主要成分为H3AsO3)制取As2O3的工艺流程如下图所示。
已知:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)
2AsS33-(aq)
(1)H3AsO3中As元素的化合价为______;H3AsO3的第一步电离方程式为:________。
(2)步骤I加入FeSO4的作用是______________________。
(3)步骤Ⅱ发生反应的化学方程式为___________________。步骤III“氧化脱硫”过程中被氧化的元素是___________(填元素符号)。
(4)步骤IV发生反应的离子方程式为________________________。
(5)利用反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
AsO33-+I2+H2O设计成原电池,起始时在甲、乙两池中分别加入图示药品并连接装置(a、b均为石墨电极)。
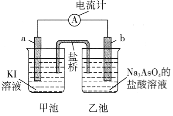
①起始时,b电极的电极反应式为__________________。
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是______________________________(举一例)。
【答案】+3 H3AsO3![]() H++H2AsO3- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)
H++H2AsO3- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡左移,提高沉砷效率 As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O S、As 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O AsO43-+2e-+2H+=AsO33-+ H2O 向乙中加入Na3AsO3固体或加入碱
2AsS33-(aq)平衡左移,提高沉砷效率 As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O S、As 2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O AsO43-+2e-+2H+=AsO33-+ H2O 向乙中加入Na3AsO3固体或加入碱
【解析】
(1)根据化合物中元素化合价的代数和等于0判断;H3AsO3是三元弱酸,根据多元弱酸分步电离书写电离方程式;
(2)根据示意图可知步骤I加入FeSO4的作用是使过量的S2-变为沉淀;
(3)步骤Ⅱ中NaOH与As2S3反应产生Na3AsO3、Na3AsS3及水,根据原子守恒、电子守恒可得反应方程式;根据被氧化的元素反应后化合价会升高分析;
(4) SO2将Na3AsO4还原为As2O3,SO2被氧化为H2SO4,然后根据电子守恒、原子守恒可得反应的方程式;
(5)①根据反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O可知,若设计原电池,I-失去电子,作负极,AsO43-在正极上发生还原反应分析;
AsO33-+I2+H2O可知,若设计原电池,I-失去电子,作负极,AsO43-在正极上发生还原反应分析;
②若再构成原电池,电极相反,则在左边发生还原反应,在右边发生氧化反应。
(1) H3AsO3中H元素化合价为+1价,O元素化合价为-2价,根据化合物中各种元素化合价的代数和等于0,可知As元素的化合价为+3价;H3AsO3的第一步电离方程式为:H3AsO3![]() H++H2AsO3-;
H++H2AsO3-;
(2)步骤I加入FeSO4的作用是使过量的S2-变为沉淀,Fe2++S2-=FeS↓,由于c(S2-)降低,使As2S3(s)+3S2-(aq)![]() 2AsS33-(aq)平衡逆向移动,从而可提高沉砷效率;
2AsS33-(aq)平衡逆向移动,从而可提高沉砷效率;
(3)步骤Ⅱ中NaOH与As2S3反应产生Na3AsO3、Na3AsS3及水,根据原子守恒、电子守恒可得反应方程式:As2S3+6NaOH=Na3AsO3+Na3AsS3+3H2O;
(4)由反应前后物质中所含元素化合价分析可知:S元素化合价由反应前Na3AsS3的-2价变为反应后S单质的0价,化合价升高,失去电子,被氧化;As元素的化合价由反应前Na3AsO3、Na3AsS3的+3价变为反应后Na3AsO4的+5价,化合价升高,失去电子,被氧化,故被氧化的元素有S、As;
(4)步骤IV中SO2具有还原性,将Na3AsO4还原为As2O3,SO2被氧化为H2SO4,发生反应的离子方程式为:2AsO43-+2SO2+2H+=As2O3+2SO42-+H2O;
(5)①根据方程式可知:I-在负极失去电子,发生氧化反应,电极式为:2I--2e-=I2,在正极上AsO43-获得电子,发生还原反应,电极反应式为:AsO43-+2e-+2H+=AsO33-+ H2O;
②一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,则左边发生还原反应右边发生氧化反应,可采取的措施是向乙中加入Na3AsO3固体或加入碱消耗I2,反应就可以发生。

 新思维寒假作业系列答案
新思维寒假作业系列答案







