��Ŀ����
����Ŀ������Ӧ�úʹ������Ļ��������������������Ҫ���塣
��1������[CO(NH2)2]��һ�ָ�Ч���ʣ�Ҳ��һ�ֻ���ԭ�ϡ�
��������Ϊԭ����һ�������·�����Ӧ��
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)��H=+133.6 kJ/mol�����ڸ÷�Ӧ������˵����ȷ����____________________������ţ���
2NH3(g)+CO2(g)��H=+133.6 kJ/mol�����ڸ÷�Ӧ������˵����ȷ����____________________������ţ���
a���ӷ�Ӧ��ʼ��ƽ��ʱ�����л�������ƽ����Է����������ֲ���
b����ƽ����ϵ������ˮ��������ʹ�÷�Ӧ��ƽ�ⳣ������
c�������¶�ʹ���ص�ת��������
d. ��С�����������ƽ�����淴Ӧ�����ƶ�������ƽ��ʱNH3��Ũ�ȴ���ԭƽ��
��������һ�������¿ɽ����������ﻹԭΪ������
��֪��
�ٽ�Ϣ��е���Ϣ����Ӧ2CO(NH2)2(s)+6NO(g)![]() 5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��_______kJ/mol��
5N2(g)+2CO2(g)+4H2O(l)�ġ�H ��_______kJ/mol��
���ܱ��������Ե����ʵ�����NH3��CO2Ϊԭ�ϣ���120�桢���������·�Ӧ�������أ�CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)�����������NH3�����ʵ����ٷֺ�����ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2��______b����淴Ӧ����v����CO2�����>������=����<������������ƽ��ת����Ϊ________________��
CO(NH2)2(s)+H2O(g)�����������NH3�����ʵ����ٷֺ�����ʱ��仯��ϵ��ͼ��ʾ����a�������Ӧ����v����CO2��______b����淴Ӧ����v����CO2�����>������=����<������������ƽ��ת����Ϊ________________��

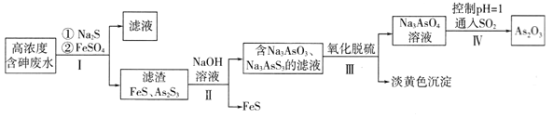
��2��NO2����Ⱦ����������Na2CO3��Һ����NO2������CO2����֪9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol���˷�Ӧ�����ӷ���ʽΪ_________��ǡ�÷�Ӧ��ʹ��Һ�е�CO2��ȫ�ݳ���������Һ�������ԣ�����Һ������Ũ�ȴ�С��ϵ��c(Na��)>______��
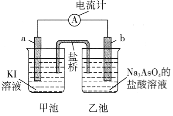
��3������ȼ�ϵ��Ϊ��Դ��ͨ�����ӽ���Ĥ��ⷨ���Ƶ��Һ��OH����Ũ�����Ʊ�����Cu2O��װ����ͼ��ʾ��

����װ����B�缫Ӧ���缫__���C����D�������õ����е����ӽ���ĤΪ__������������������ӽ���Ĥ��
���𰸡�a -1804.7kJ/mol > 75% 2NO2+ CO32��=CO2+ NO2��+ NO3�� c��NO3����> c��NO2����> c��OH����>c��H���� D ��
��������
��1���ٻ�ѧƽ�ⳣ����ָ��һ���¶��£����淴Ӧ����ƽ��ʱ���������Ũ��ϵ������֮���뷴Ӧ���Ũ��ϵ������֮���ıȣ����塢��Һ�岻��Ҫ�ڻ�ѧƽ�ⳣ����д����
a�����������ֻ�а�����������̼���������ʵ���֮��Ϊ��ֵ2��1��ƽ����Է����������䣻
b��ƽ�ⳣ��ֻ���¶�Ӱ�죻
c������ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
d. ��С�����������ƽ��������������������Ӧ�����ƶ���
��������һ�������¿ɽ����������ﻹԭΪ��������Ӧ����ʽΪ��2 CO��NH2��2��s��+6 NO��g��=5 N2��g��+2CO2��g��+4 H2O��l����
��֪����CO(NH2)2 ��s��+H2O��l��![]() 2NH3��g��+CO2��g����H=+133.6kJ/mol��
2NH3��g��+CO2��g����H=+133.6kJ/mol��
��ͼ�ɵ��Ȼ�ѧ����ʽ����4NH3��g��+6 NO��g��=5 N2��g��+6H2O��l����H=-2071.9 kJ/mol��
���ݸ�˹���ɣ�����2+�ڿɵã�2 CO��NH2��2��s��+6 NO��g��=5 N2��g��+2CO2��g��+4 H2O��l����
��a��δ����ƽ�⣬��Ӧ����������Ӧ���У�����Ӧ���ʼ�С���淴Ӧ��������b��ƽ��״̬ʱ����������ȣ�
��NH3��CO2����ʼ���ʵ���Ϊ1mol��ƽ��ʱ����ת����Ϊx����ʾ��ƽ��ʱ��������ʵ�������ϰ������������20%�з��̼��㣻
��2��9.2gNO2�����ʵ���![]() =0.2mol��Na2CO3��Һ��ȫ��Ӧ����CO2ʱת�Ƶ���0.1mol����Ӧ��ֻ��NԪ�ػ��ϼ۱仯����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ���Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2���ڼ�����Һ��Ӧ����NaNO3��NaNO2������Ũ����ȣ�NO2-ˮ����Һ�ʼ��ԡ�
=0.2mol��Na2CO3��Һ��ȫ��Ӧ����CO2ʱת�Ƶ���0.1mol����Ӧ��ֻ��NԪ�ػ��ϼ۱仯����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ���Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2���ڼ�����Һ��Ӧ����NaNO3��NaNO2������Ũ����ȣ�NO2-ˮ����Һ�ʼ��ԡ�
��1����a����������ƽ����Է�������= ![]() ����Ӧ��ֻ�������������̼�Ͱ���Ϊ������ʼ�հ����ʵ���֮��Ϊ1��2���ɣ��ʻ�������ƽ����Է�������ʼ�ղ��䣬ѡ��a��ȷ��
����Ӧ��ֻ�������������̼�Ͱ���Ϊ������ʼ�հ����ʵ���֮��Ϊ1��2���ɣ��ʻ�������ƽ����Է�������ʼ�ղ��䣬ѡ��a��ȷ��
b���¶Ȳ��䣬��ѧƽ�ⳣ�����䣬ѡ��b����
c����ӦCO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g)��H=+133.6 kJ/mol����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ������ص�ת���ʼ�С��ѡ��c����
2NH3(g)+CO2(g)��H=+133.6 kJ/mol����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ������ص�ת���ʼ�С��ѡ��c����
d. ��С�����������ƽ��������������������Ӧ�����ƶ�������ƽ��ʱ�����������ı�������ƽ���ƶ�����İ��������ı�����NH3��Ũ��С��ԭƽ�⣬ѡ��d����
��ѡa��
��������һ�������¿ɽ����������ﻹԭΪ��������Ӧ����ʽΪ��2 CO��NH2��2��s��+6 NO��g��=5 N2��g��+2CO2��g��+4 H2O��l����
��֪����CO��NH2��2 ��s��+H2O��l��![]() 2NH3��g��+CO2��g����H=+133.6kJ/mol��
2NH3��g��+CO2��g����H=+133.6kJ/mol��
��ͼ�ɵ��Ȼ�ѧ����ʽ����4NH3��g��+6 NO��g��=5 N2��g��+6H2O��l����H=-2071.9 kJ/mol��
���ݸ�˹���ɣ�����2+�ڿɵã�2CO��NH2��2��s��+6NO��g��=5N2��g��+2CO2��g��+4H2O��l����H=-1804.7KJ/mol��
�۰��������������50%�仯Ϊ20%������������ֲ��䣬˵��b�㷴Ӧ�ﵽƽ��״̬��a�㰱������ٷֺ�������b�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��a�������Ӧ���ʴ���b�������Ӧ���ʣ���v����CO2����v����CO2����
��NH3��CO2����ʼ���ʵ���Ϊ1mol��ƽ��ʱ����ת����Ϊx����
CO2��g��+2NH3��g��![]() CO ��NH2��2 ��s��+H2O��g����
CO ��NH2��2 ��s��+H2O��g����
��ʼ����mol����1 1 0
�仯����mol����0.5x x 0.5x
ƽ������mol����1-0.5x 1-x 0.5x
�������������=![]() =20%�����x=75%��
=20%�����x=75%��
��2��9.2gNO2�����ʵ���![]() =0.2mol��Na2CO3��Һ��ȫ��Ӧ����CO2ʱת�Ƶ���0.1mol����Ӧ��ֻ��NԪ�ػ��ϼ۱仯����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ���Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2���ڼ�����Һ��Ӧ����NaNO3��NaNO2������Ũ����ȣ�NO2-ˮ����Һ�ʼ��ԣ�������Һ�е�����Ũ�ȴ�С��ϵΪc��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
=0.2mol��Na2CO3��Һ��ȫ��Ӧ����CO2ʱת�Ƶ���0.1mol����Ӧ��ֻ��NԪ�ػ��ϼ۱仯����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ���Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2���ڼ�����Һ��Ӧ����NaNO3��NaNO2������Ũ����ȣ�NO2-ˮ����Һ�ʼ��ԣ�������Һ�е�����Ũ�ȴ�С��ϵΪc��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
��3��ȼ�ϵ������ͨ����������ͨȼ�ϣ���CΪ������DΪ������ͭ�缫�������������ĵ缫����ʽΪ2Cu+2OH--2e-=Cu2O+H2O����ͭΪ��������ԭ��ص�������������B��D��A��C��������ѡB��
�����ܷ�Ӧ����������ӦΪ2Cu+2OH--2e-=Cu2O+H2O���������ӽ���ĤӦ���������ӽ���Ĥ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ������ͼ��ʾװ��(�г���װ��ʡ��)��������ʵ�飬�ܵó���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | ϡ���� | Na2S | AgNO3��AgCl����Һ | Ksp(AgCl)>Ksp(Ag2S) | |
B | Ũ���� | ���� | ��ˮ | Ũ���������ˮ�ԡ������� | |
C | ϡ���� | Na2CO3 | CaCl2��Һ | CO2�����Ȼ��Ʒ�Ӧ | |
D | Ũ���� | Na2CO3 | Na2SiO3��Һ | ���ԣ�����>̼��>���� |
A. AB. BC. CD. D