题目内容
4.环境污染已是我国生产、生活中面临的一项重大问题,要治理和防止污染,首先要弄清引起污染的原因,请将下列污染原因与结果用线连接起来:
分析 氟利昂等排放物,能够引起臭氧层的破坏;
砍伐森林,会破坏生态环境,当土地失去植被后,就会使土地干旱甚至沙漠化;
核材料有放射性,会形成放射性污染,使人患放射病;
二氧化碳的大量排放能够引起温室效应;
大量使用农药,会污染土壤,导致水体被污染;
二氧化硫的排放能引起酸雨.
解答 解:氟利昂等排放物,能够引起臭氧层的破坏,所以氟利昂等排放物和臭氧层破坏搭配;
砍伐森林,会破坏生态环境,当土地失去植被后,就会使土地干旱甚至沙漠化,所以砍伐森林与土地沙漠化搭配;
核材料有放射性,会形成放射性污染,使人患放射病,所以核污染与放射性病和癌症的发病率增加搭配;
二氧化碳的大量排放能够引起温室效应,所以二氧化碳浓度逐年增加与温室效应搭配;
大量使用农药,会污染土壤,导致水体被污染,所以大量使用农药与土壤和水污染搭配;
二氧化硫的排放能引起酸雨,所以汽车、煤等排放二氧化硫等于酸雨搭配;
故答案为: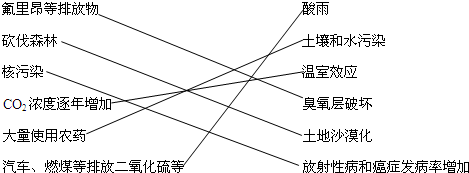 .
.
点评 本题考查了常见的环境污染问题,熟悉相关环境污染知识即可解答,注意对相关知识的积累,题目难度不大.

练习册系列答案
相关题目
1.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
2. 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )| A. | 打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处 | |
| B. | 开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应 | |
| C. | 反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生 | |
| D. | 若用苯或酒精来代替煤油,可观察到相同的实验现象 |
12.近年来,“地沟油”的处理成为一个与食品安全密切相关的话题.据报道,2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.下列方法中,能区别地沟油(餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是( )
| A. | 加入水中,浮在水面上的是地沟油 | |
| B. | 测定沸点,有固定沸点的是矿物油 | |
| C. | 点燃,能燃烧的是矿物油 | |
| D. | 加入含酚酞的氢氧化钠溶液,加热,红色变浅或消失的是地沟油 |
19.下列反应中不属于取代反应的范畴的是( )
| A. |  $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O | |
| B. | CH3CH2Br+NaOH→CH3CH2OH+NaBr | |
| C. | CH3COOH+CH3OH $?_{加热}^{催化剂}$?CH3COOCH3+H2O | |
| D. | RCOOCH3+H2O $\stackrel{H_{2}SO_{4}}{?}$ RCOOH+CH3OH |
9.下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )
| 物质 | 杂质 | 试剂或方法 | |
| A | 碘水 | Br2 | 乙醇、萃取 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | 盐酸 |
| D | NaHCO3溶液 | Na2CO3 | 通入过量的CO2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
16.下列实验操作正确且能达到实验目的是( )
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| C | 确定溴乙烷中含有溴元素 | 与NaOH溶液共热,再往混合液中滴加AgNO3溶液,观察是否有浅黄色沉淀生成 |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
13. 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,将其分成两等份.向第一份中逐渐加入铜粉,最多能溶解19.2g(假设硝酸仅被还原为N0气体,下同).向第二份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 原混合溶液中NO3-的物质的量为0.4 mol | |
| B. | OA段、BC段产生的气体分别是N0、H2 | |
| C. | 第二份溶液中最终溶质为FeS04 | |
| D. | 原混合溶液中H2S04的浓度为5 mol•L-1 |
14.下列实验现象预测或实验操作或实验原理正确的是( )


| A. | 实验Ⅰ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性:Cl2>Br2>I2 | |
| B. | 实验Ⅱ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 | |
| C. | 实验Ⅲ:可通过铜丝的上下移动来控制NO2的制取并收集NO2气体 | |
| D. | 实验Ⅳ:振荡后静置,溶液不再分层,且保持无色透明 |