题目内容
9.下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )| 物质 | 杂质 | 试剂或方法 | |
| A | 碘水 | Br2 | 乙醇、萃取 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | 盐酸 |
| D | NaHCO3溶液 | Na2CO3 | 通入过量的CO2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A.乙醇与水互溶;
B.二者均与Fe反应;
C.二者均与盐酸反应;
D.碳酸钠与二氧化碳、水反应生成碳酸氢钠.
解答 解:A.乙醇与水互溶,则乙醇不能作萃取剂,且溴、碘均易溶于酒精,不能除杂,故A错误;
B.二者均与Fe反应,不能除杂,应加足量Fe反应后过滤,向滤液中通足量氯气,故B错误;
C.二者均与盐酸反应,不能除杂,应选NaOH溶液、过滤来除杂,故C错误;
D.碳酸钠与二氧化碳、水反应生成碳酸氢钠,则通入过量的CO2可除杂,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的化学反应、混合物分离方法等为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

练习册系列答案
相关题目
6.金属铝在高温条件下与三氧化二铁发生的置换反应称为铝热反应.铝热反应可以应用在生产上,如焊接钢轨等.某教科书对“铝热反应”实验的现象有这样的描述:“反应放出大量的热,并发出耀眼的白光”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.
现已知:Al、Fe的熔点、沸点数据如下:
(1)某同学猜测,铝热反应所得到的熔融物是铁铝合金.理由是:该反应放热能使铁熔化,而铝的熔点比铁低,所以铁和铝能形成合金.你认为他的解释合理(填“合理”或“不合理”).
(2)根据已有知识设计一种验证铝热反应所得到的熔融物凝固后的固体中有单质铁的最简单物理方法:用磁铁,若能吸引则可验证产物中有Fe.
(3)设计一个简单的实验方案,证明铝热反应所得到的熔融物凝固后的固体中含有单质铝.请填写下列表格:
现已知:Al、Fe的熔点、沸点数据如下:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
(2)根据已有知识设计一种验证铝热反应所得到的熔融物凝固后的固体中有单质铁的最简单物理方法:用磁铁,若能吸引则可验证产物中有Fe.
(3)设计一个简单的实验方案,证明铝热反应所得到的熔融物凝固后的固体中含有单质铝.请填写下列表格:
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
7.短周期的三种元素分别为X,Y和Z,已知X原子最外层只有一个电子,Y原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z原子的L电子层上的电子数比Y元素原子的L电子层上的电子数少2个.下列说法中不正确的是( )
| A. | 三种元素可组成为X3YZ4型的化合物 | |
| B. | 三种元素相互作用所形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X和Z形成的化合物中可能既有极性键又有非极性键 | |
| D. | Y元素形成的单质可能是最常用的半导体材料 |
17.分子式为C5H11Cl的同分异构体具有的种类为( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.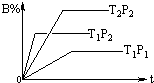 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
 已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g),在密闭容器中进行,如图表示在不同时间t、温度T、压强p与反应物B的百分含量的关系曲线,下列判断正确的是( )| A. | T2>T1 P1>P2 m+n>P△H<0 | B. | T1>T2 P1<P2 m+n<P△H>0 | ||
| C. | T1<T2 P1<P2 m+n<P△H<0 | D. | T1>T2 P1<P2 m+n>P△H>0 |
1.常温下,下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在含有大量H+溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 在含有大量OH-溶液中:CO32-、Na+、SO42-、NO3- | |
| D. | 在酸性的溶液中:K+、I-、Cl-、NO3- |




