题目内容
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0 kJ/mol
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。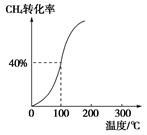
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________;
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将1.0 mol CO与2.0 mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的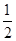 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减小 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH的物质的量增加 |
D.重新平衡时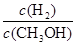 减小 减小 |
(4)工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g)
 CO(g)+2H2(g),此反应能自发进行的原因是:___。
CO(g)+2H2(g),此反应能自发进行的原因是:___。(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
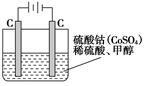
①写出阳极电极反应式_______________;
②写出除去甲醇的离子方程式___________________。
(1)CH4(g)+H2O(g) CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g)ΔH=+77.0 kJ·mol-1
(2)①0.0024 mol·L-1·min-1 ②7.2×10-5
(3)CD
(4)该反应是一个熵增的反应(ΔS>0)
(5)①Co2+-e-=Co3+ ②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
解析

25 ℃时,在体积为2 L的密闭容器中,气态A、B、C的物质的量n随时间t的变化如图1所示,已知达到平衡后,降低温度,A的转化率将增大。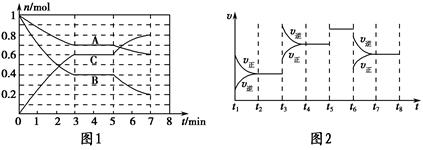
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K1 | K2 | K3 | K4 |
(1)根据图1数据,写出该反应的化学方程式:__________________。此反应的平衡常数表达式K=________,从反应开始到第一次平衡时的平均速率v(A)为________。
(2)在5~7 min内,若K值不变,则此处曲线变化的原因是________________。
(3)如图2表示此反应的反应速率v和时间t的关系图,各阶段的平衡常数如表所示。K1、K2、K3、K4之间的关系为________(用“>”、“<”或“=”连接)。A的转化率最大的一段时间是________。
在10 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答:
(1)该反应为 (填“吸热”或“放热”)反应。
(2)该反应的化学平衡常数表达式为K = 。
(3)能说明该反应达到化学平衡状态的是 (填字母)。
a.υ正(CO2)=υ正(H2) b.υ逆(CO)=υ逆(H2O)
c.υ逆(H2)=υ逆(H2O) d.υ正(H2)=υ逆(H2)
(4)某温度下,将CO2和H2各0.10 mol充入该容器中,达到平衡后,测得 c(CO)="0.0080" mol·L-1,则CO2的转化率为 。
(5)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。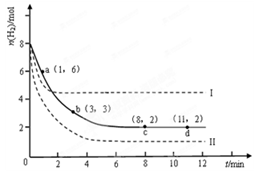
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是 ( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的转化率大于80%
 (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1

 CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
 CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: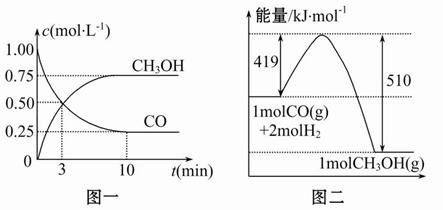
 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答:
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图⑴所示。请回答: