��Ŀ����
��֪��2NO2(g) N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ����ʾ����ش�
N2O4(g)����H��0���ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2L���ܱ������У���Ӧ�����и����ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ��ͼ����ʾ����ش�
��1��a��ʱ��v(��) v���棩�����������������=������X�ߡ�Y���д���N2O4���� ��
��2����Ӧ�ڵ�10 min�ﵽƽ�⣬��ǰ10 min����N��2��ʾ�Ļ�ѧ��Ӧ����v(N��2)= mol��L-1��min-1�����¶��£���Ӧ��ƽ�ⳣ��K= (���÷�����ʾ)��
��3���ڵ�25���ӣ����еIJ����� ��
��4��a��b��c��d�ĵ��Ӧ��ʱ�̣�NO2���ʵ���Ũ����С�����˳���� ���ٴ�ƽ��ʱ��d��NO2�����������b��ʱ �������С������ȡ�����
��5�������ڵ�35���Ӵ���������ȥ0.4mol N2O4���������ʵ�����ʹ��Ӧ�ڵ�40���Ӵﵽƽ�⣬����ͼ���л����ӵ�35�����Ժ��������ʵ����ʵ���Ũ��c��ʱ��t�ı仯��ϵ������ע����������Ӧ�����ʡ�
��1���� ��1�֣� Y�ߣ���1�֣���2��0.04��2�֣� 10/9(��1.1)��2�֣�����3������0.8mol NO2����2�֣���4��a��b��d��c ��2�֣� С��2�֣�
��5��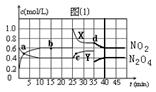 ��2�֣�
��2�֣�
���������������1����ͼ��֪10-25minƽ��״̬ʱ��X��ʾ���������Ũ�ȱ仯��Ϊ��0.6-0.2��mol/L=0.4mol/L��Y��ʾ�ķ�Ӧ���Ũ�ȱ仯��Ϊ��0.6-0.4��mol/L=0.2mol/L��X��ʾ���������Ũ�ȱ仯����Y��ʾ�ķ�Ӧ���Ũ�ȱ仯����2��������X��ʾNO2Ũ����ʱ��ı仯���ߣ�Y��ʾN2O4Ũ����ʱ��ı仯���ߣ���2��ƽ�ⳣ��ָ�ﵽƽ��ʱ��������Ũ�ȵĻ�ѧ���������ݵij˻����Ը���Ӧ��Ũ�ȵĻ�ѧ���������ݵij˻����õı�ֵ������ͼ����ƽ��ʱ����ֵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣻��3��25minʱ��c��NO2��˲������ƽ��״̬�����ˣ�1-0.6����2=0.8mol ����c��NO2����ƽ��������N2O4�����ƶ���4����a��b��c��NO2������c���d��ֱ�������c��NO2����δ�ﵽƽ��ĵ��ƽ��ʱ�ĵ㣬����c��c��NO2������d�㣬��������Ũ��Խ����ɫԽ�����ɫ���dz��˳����cdba����ͼ��֪��10-25min��35min֮��X��Y�����ʵ����������仯������Ӧʱ����ڵĵ㴦�ڻ�ѧƽ��״̬��d��NO2�����������b��ʱС����5����ͼ��
���㣺���⿼��ƽ�ⳣ����ƽ���ƶ���ƽ��Ӱ�����ء���ѧƽ��ͼ��ȣ��Ѷ��еȣ�ͼ��������ⲽ�裺��1��
����ͼ�ٿ��棨��Ū�������������������壩���ڿ��ߣ���Ū���ߵ�����ͱ仯���ƣ����ۿ��㣨��Ū����㡢�յ㡢���㡢�յ�����壩���ܿ��Ƿ�Ҫ�������ߣ�������ߡ���ѹ�ߣ����ݿ�����ͼ
�����й����Ķ��٣���2��������ɣ�������������ĸı�Ի�ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ����ɣ�

��Դ����������������ٵ��ش���⣬�״���δ����Ҫ����ɫ��Դ֮һ����CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
��.CH4��g����H2O��g��=CO��g����3H2��g����H����206.0 kJ/mol
��.CO��g����2H2��g��=CH3OH��g����H����129.0 kJ/mol
��1��CH4��g����H2O��g����Ӧ����CH3OH��g����H2��g�����Ȼ�ѧ����ʽΪ_____��
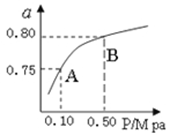
��2����1.0 mol CH4��2.0 mol H2O��g��ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����Ӧ�����һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ��ͼ��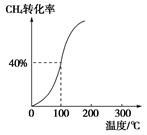
�ټ���100 ��ʱ�ﵽƽ�������ʱ��Ϊ5 min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ________��
��100 ��ʱ��Ӧ���ƽ�ⳣ��Ϊ________��
��3����ѹǿΪ0.1 MPa���¶�Ϊ300 �������£���1.0 mol CO��2.0 mol H2�Ļ�������ڴ��������·�����Ӧ�����ɼ״���ƽ����������ݻ�ѹ����ԭ���� �������������䣬��ƽ����ϵ������Ӱ����________������ĸ��ţ���
�������������䣬��ƽ����ϵ������Ӱ����________������ĸ��ţ���
| A��c��H2����С |
| B������Ӧ���ʼӿ죬�淴Ӧ���ʼ��� |
| C��CH3OH�����ʵ������� |
D������ƽ��ʱ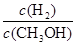 ��С ��С |
��4����ҵ�����ü״��Ʊ������ij��÷����м״��������������÷��е�һ����Ҫ��ӦΪCH3OH��g��
 CO��g����2H2��g�����˷�Ӧ���Է����е�ԭ���ǣ�___��
CO��g����2H2��g�����˷�Ӧ���Է����е�ԭ���ǣ�___����5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ���ǣ�ͨ���Co2��������Co3����Ȼ����Co3������������ˮ�еļ״�������CO2��������ʵ��������ͼװ��ģ���������̣�
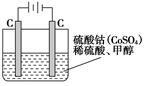
��д�������缫��Ӧʽ_______________��
��д����ȥ�״������ӷ���ʽ___________________��
����ʮ�˴����״�����������й����ĺ�ΰĿ�ꡣ���ܼ������й�ת�ͷ�չ�ıؾ�֮·����ҵ����������������ʵ�ֽ��ܼ��ŵ���Ҫ��ʩ����ͼ�Ǽ��ֹ�ҵ�����������������գ�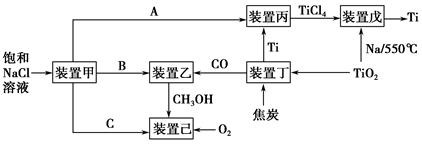
��ش��������⣺
��1��װ�ü�Ϊ���أ�����ͼʾת����ϵ��֪��AΪ____________���ѧʽ����������ӦʽΪ____________��
��2��װ�ñ��ķ�Ӧ��ΪTi����װ�����������ΪTi��������װ���ڸ����������в���ì�ܣ�ԭ����_________________________________________________
װ������з�Ӧʱ��Ҫ�Ļ���Ϊ________������ĸ��ţ���
A��HCl�����Χ�� B��������Χ�� C�������Χ�� D��ˮ��
��3��װ�����з������ǹ�ҵ�ϳɼ״��ķ�Ӧ��CO��g����2H2��g��??CH3OH��g������H<0��
�ٸ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K�����±���
| �¶�/�� | 250 | 350 |
| K | 2.041 | x |
���ϱ��е�ƽ�ⳣ��x����ֵ��________������ĸ��ţ���
A��0 B��0.012 C��32.081 D��100
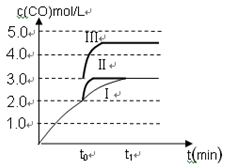
����װ����Ϊ�ݻ��̶����ܱ���������ͬʱ��θ����ʵ�Ũ�����±���
| | c��CO�� | c��H2�� | c��CH3OH�� |
| 0 min | 0.8 mol��L��1 | 1.6 mol��L��1 | 0 |
| 2 min | 0.6 mol��L��1 | y | 0.2 mol��L��1 |
| 4 min | 0.3 mol��L��1 | 0.6 mol��L��1 | 0.5 mol��L��1 |
| 6 min | 0.3 mol��L��1 | 0.6 mol��L��1 | 0.5 mol��L��1 |
��Ӧ��2 min��4 min֮�䣬H2��ƽ����Ӧ����Ϊ________����Ӧ�ﵽƽ��ʱCO��ת����Ϊ________����Ӧ�ڵ�2 minʱ�ı��˷�Ӧ�������ı������������________������ĸ��ţ���
A��ʹ�ô��� B�������¶�
C������H2��Ũ��
��4��װ�ü����Կ���ȼ�ϵ�أ���ȼ�ϵ�صĸ�����ӦʽΪ____________ ________________________________________________��
��ҵ���Ʊ�H2��һ����Ҫ�����ǣ� CO(g) + H2O(g)  CO2 (g) + H2(g) ��H��Q kJ/mol ����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У� 850�� ʱ����������Ӧ����������ڸ����ʵ�Ũ�� (mol/L)��ʱ��ı仯��ϵ���±���
CO2 (g) + H2(g) ��H��Q kJ/mol ����֪�÷�Ӧ��ƽ�ⳣ��K���¶�T�Ĺ�ϵ��ͼ��ʾ������һ�̶����ܱ������У� 850�� ʱ����������Ӧ����������ڸ����ʵ�Ũ�� (mol/L)��ʱ��ı仯��ϵ���±���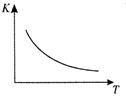
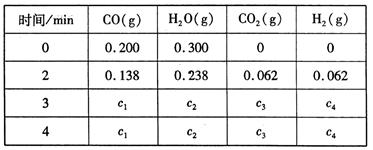
��֪��850�� ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��K ="1.0" ����ش��������⣺
��1��Q 0��� �� ������ �� ������ ����
��2�������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������� ������ĸ����
| A����λʱ���ڼ��� CO(g)��Ũ�ȵ������� CO2 (g)��Ũ�� |
| B����Ӧ�����ڵ�ѹǿ�������仯 |
| C����������� H2 (g)��Ũ�Ȳ��ٷ����ı� |
| D���������������ʵ���ˮ���������� |
��4���ϱ��� c2Ϊ mol/L , CO(g)��ת����Ϊ
ij�¶��£���2mol A��2.8 mol B�������Ϊ2 L�ĺ����ܱ������У��������·�Ӧ��
aA��g��+B��g�� 2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
2C��g��+ D��s�� ��5 min��ﵽƽ�⡣ƽ��ʱAΪ1.6mol���ų�������ΪQ����t0ʱ�̣�����ƽ����ϵ�з�����ķ�֮һ�Ļ�����壬��ƽ����ϵ��c(A)Ϊ0.6mol��L��
��1�� 5 min����B��ʾ�÷�Ӧ�Ļ�ѧ��Ӧ����Ϊ ��
��2�����¶��£��˿��淴Ӧ���淴Ӧ��ƽ�ⳣ��Ϊ ��
��3��a��ֵΪ ��
��4������˵��һ����˵��������Ӧ�Ѵﵽƽ��״̬���� ��
�ٵ�λʱ����ÿ����1molB��ͬʱ������2mol��C ��D�����ʵ������ٱ仯
�ۻ��������ܶȲ��ٱ仯 �ܻ�������ƽ����Է����������ٱ仯
����ϵ��ѹǿ���ٱ仯
��5�����¶��£�ijͬѧ���������ʵ�飬���ڿո���������������Q�ı���ʽ��ʾ��
| ��ʼ n��A��/mol | ��ʼ n��B��/mol | ��ʼ n��C��/mol | ��ʼ n��D��/mol | �ﵽƽ��ʱ�ų��������գ������� |
| 0 | 1.6 | 8 | ���� | |


 2NH3(g)����H��Q kJ��mol��1�������仯����ͼ���ش��������⣺
2NH3(g)����H��Q kJ��mol��1�������仯����ͼ���ش��������⣺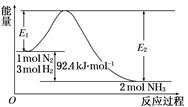


 Ni(CO)4(g)��Q
Ni(CO)4(g)��Q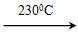 Ni(s)��4CO(g)
Ni(s)��4CO(g)