题目内容
15.(某镁铝合金(MgxAly)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Mg、Al单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入500mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图2所示.完成下列问题: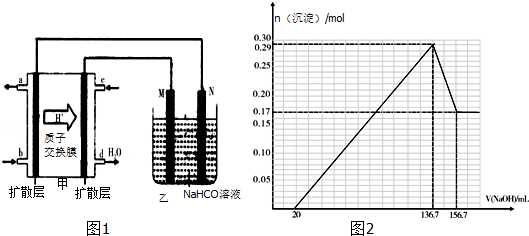
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是防止镁铝被空气氧化.
(2)该镁铝合金(MgxAly)的化学式为Mg17Al12.
(3)NaOH溶液的物质的量浓度为6mol•L-1.
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1.得到的混合物在6.0mol•L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为52mol.
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应Al+4OH--3e-=AlO2-+2H2O.
(6)如图1甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是Al.
分析 (1)金属镁和铝容易被氧气氧化,进入氩气可以防止镁铝被氧化;
(2)根据图2加入136.7mL氢氧化钠溶液时恰好生成0.29mol氢氧化铝和氢氧化铝沉淀,加入156.7mL氢氧化钠溶液时,沉淀被溶解的为氢氧化铝,据此可以计算出氢氧化铝、氢氧化铝的物质的量,根据质量守恒可知镁铝的物质的量之比;
(3)根据氢氧化铝与氢氧化钠反应的方程式及氢氧化铝的物质的量、氢氧化钠的体积计算出氢氧化钠的浓度;
(4)释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
(5)镁不与氢氧化钠溶液反应,铝能够与氢氧化钠溶液反应,所以负极为铝,正极为镁,负极铝失去电子与氢氧根离子反应生成偏铝酸根离子,据此写出电极反应;
(6)根据图1中反应产物判断原电池电极,然后判断电解池的阴、阳极.
解答 解:(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是防止镁铝被空气中的氧气氧化,
故答案为:防止镁铝被空气氧化;
(2)氢氧化镁和氢氧化铝总物质的量为:0.29mol,加入过量氢氧化钠溶液后,剩余的0.17mol沉淀为氢氧化镁,则氢氧化铝沉淀的物质的量为0.12mol,根据质量守恒定律可知,原合金中镁和铝的物质的量之比为:0.17mol:0.12mol=17:2,所以该镁铝合金(MgxAly)的化学式为:Mg17Al12,
故答案为:Mg17Al12;
(3)溶解0.12mol氢氧化铝消耗氢氧化钠的体积为:(156.7-136.7)mL=20mL,根据反应方程式Al(OH)3+OH-=AlO2-+2H2O可知,氢氧化钠的物质的量浓度为:$\frac{0.12mol}{0.02L}$=6mol•L-1,
故答案为:6mol•L-1;
(4)1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,1molMg17Al12完全反应生成氢气的物质的量分别为地17mol、18mol,则生成氢气一共(17+17+18)mol=52mol,
故答案为:52mol;
(5)由于镁不与氢氧化钠溶液反应,所以负极为铝,电解质为氢氧化钠溶液的负极反应为:Al+4OH--3e-=AlO2-+2H2O,
故答案为:Al+4OH--3e-=AlO2-+2H2O;
(6)由装置图可知,b极通入气体后产生气体,c极通入气体后产生水,故b极通入为甲醇,c极通入的是氧气,原电池负极发生氧化反应,正极反应还原反应,所以b为正极,c为负极,M连接的为电源正极,则M为阳极,Al在阳极放电;
故答案为:Al.
点评 本题考查了有关混合物的简单计算、原电池、电解池工作原理等知识,题目难度中等,试题题量稍大,掌握掌握原电池、电解池工作原理,明确混合物组成的计算方法.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案| A. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),得到如表三组数据;
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO2 | H2 | H2 | C2H5OH | |||
| 1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
| 2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
| 3 | 900 | 4 | 8.8 | C | d | t |
②900℃化学平衡常数为0.12,第3组与第2组相比CO2的转化率增大(填“增大”“减小”“不变”不能确定).
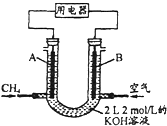
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
①0<V≤44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O
②44.8L<V≤89.6L时,负极电极反应为CH4-8e-+9CO32-+3H2O=10HCO3-
③V=67.2L时,溶液中离子浓度大小关系为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
| 操 作 | 现 象 |
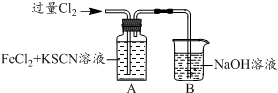 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液,甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
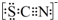 .
.①同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成NO3-
④SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| A. | ①②⑤ | B. | ③⑥ | C. | ①②④ | D. | ②④⑤⑥ |
| A. | 肉类富含蛋白质,属于碱性食物 | |
| B. | 碳酸氢钠可用于治疗胃酸过多 | |
| C. | 碘是人体必需的微量元素之一 | |
| D. | 食用富含维生素C的水果有益于身体健康 |
| A. | Na | B. | Na2O | C. | NaOH | D. | Na2CO3 |