题目内容
3.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在1L 0.1mol/L的碳酸钠溶液中,氧原子总数为0.3 NA | |
| B. | 1molAl3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32gO${\;}_{2}^{-}$中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
分析 A、在碳酸钠溶液中,除了碳酸钠本身,水也含氧原子;
B、一个氢氧化铝胶粒是多个氢氧化铝的聚集体;
C、求出O${\;}_{2}^{-}$的物质的量,然后根据1molO${\;}_{2}^{-}$中含17mol电子来分析;
D、标况下苯为液态.
解答 解:A、在碳酸钠溶液中,除了碳酸钠本身,水也含氧原子,故溶液中的氧原子的个数大于0.3NA个,故A错误;
B、一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故得到的氢氧化铝胶粒个数小于NA个,故B错误;
C、32gO${\;}_{2}^{-}$的物质的量为1mol,而1molO${\;}_{2}^{-}$中含17mol电子即17NA个,故C正确;
D、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.下列物质间的转化在给定条件下不能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(ap)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
11.下列有关物质性质的应用正确的是( )
| A. | SO2具有漂白性,所以可以使溴水褪色 | |
| B. | 金属钠硬度小、密度小,可用于制造高压钠灯 | |
| C. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| D. | 常温下浓H2SO4和浓HNO3都能使Cu发生钝化 |
18.下列除去杂质的方法正确的是( )
| A. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 |
8.下列反应或过程能量变化符合图示的是( )
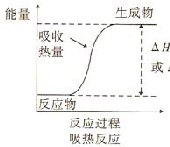

| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2Al+Fe2O3=Al2O3+2Fe | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
13.下列实验操作完全正确的是( )
| A. | 酸碱中和滴定曲线绘制实验测试和记录pH的间隔时间要相同 | |
| B. | 配置一定浓度的氯化钾溶液0.1mol/L准确称取氯化钾固体,量筒量取1000ml水倒入容量瓶中,溶解,震荡摇匀,定容 | |
| C. | 排除碱式滴定管尖嘴部分的气泡将胶管弯曲使玻璃尖嘴断向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| D. | 取出分液漏斗中所需的上层液体下层液体从分液漏斗下端尖口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端管口放出 |
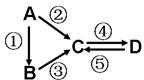 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: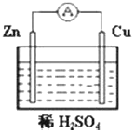 如图所示装置:
如图所示装置: