题目内容
13.下列实验操作完全正确的是( )| A. | 酸碱中和滴定曲线绘制实验测试和记录pH的间隔时间要相同 | |
| B. | 配置一定浓度的氯化钾溶液0.1mol/L准确称取氯化钾固体,量筒量取1000ml水倒入容量瓶中,溶解,震荡摇匀,定容 | |
| C. | 排除碱式滴定管尖嘴部分的气泡将胶管弯曲使玻璃尖嘴断向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| D. | 取出分液漏斗中所需的上层液体下层液体从分液漏斗下端尖口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端管口放出 |
分析 A.滴定终点附近间隔要小些;
B.容量瓶只能配制溶液,不能溶解或稀释药品;
C.将碱式滴定管的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,可排除尖嘴部分的气泡;
D.分液时,下层液体从下口流出,上层液体只能从上口倒出.
解答 解:A.滴定终点附近间隔要小些,否则可能产生较大误差,故A错误;
B.容量瓶只能配制溶液,不能溶解或稀释药品,称量的固体药品应该放在烧杯中溶解,故B错误;
C.将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡,故C正确;
D.分液时,下层液体从下口流出,上层液体只能从上口倒出,若从下口流出,会混有下层液体,故D错误.
故选C.
点评 本题考查化学实验方案评价,涉及中和滴定、物质的分离提纯等知识点,明确实验原理是解本题关键,会从实验操作规范性及评价性进行分析判断,难度不大.

练习册系列答案
相关题目
3.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1L 0.1mol/L的碳酸钠溶液中,氧原子总数为0.3 NA | |
| B. | 1molAl3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32gO${\;}_{2}^{-}$中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
4.以下说法错误的是( )
| A | 2Na+2H2O=2NaOH+H2↑ 2Al+2H2O+2NaOH=2NaAlO2+3H2↑ | 均为水做氧化剂的氧化还原反应 |
| B | Fe+CuSO4=FeSO4+Cu 点燃 2Mg+CO22MgO+C | 均为固体质量增大的置换反应 |
| C | NaAlO2+SO2+2H2O=Al(OH)3+NaHSO3 NaClO+CO2+H2O=HClO+NaHCO3 | 均为较强酸制较弱酸的复分解反应 |
| D | H2O2+SO2=H2SO4 CaO+SO3=CaSO4 | 均为非氧化还原反应的化合反应 |
| A. | A | B. | B | C. | C | D. | D |
1.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下11.2LO2和16gO3中含有的O数均为 NA | |
| B. | 32g氧气所含质子数为NA | |
| C. | 1mol/L的CaCl2溶液中含有的Cl-为2NA | |
| D. | 12.6g水所含电子数目为0.7NA |
18.下列说法正确的是( )
| A. | 在化学反应中,化学能只可以转化为热能 | |
| B. | 合成氨反应N2+3H2?2NH3,当N2、H2、NH3浓度相等时该反应达到了最大限度 | |
| C. | 合成氨反应N2+3H2?2NH3中,升高温度,该反应速率减小 | |
| D. | 化学键的断裂和形成是化学反应中能量变化的主要原因 |
5.下列反应 属于氧化还原反应,水做氧化剂的是( )
| A. | Na2O+H2O═2NaOH | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na2O2+2 H2O═4NaOH+O2↑ | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
2.下列有机物命名正确的是( )
| A. | 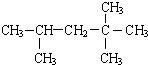 2,4,4-三甲基戊烷 2,4,4-三甲基戊烷 | B. | 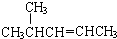 4-甲基-2-戊烯 4-甲基-2-戊烯 | ||
| C. | 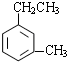 邻甲乙苯 邻甲乙苯 | D. | 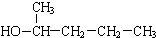 1-甲基-1-丁醇 1-甲基-1-丁醇 |
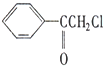 中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:
中国是《日内瓦协定书》的缔约国,反对使用化学武器,反对任何形式的化学武器扩散.苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为: 、
、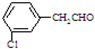 、
、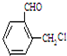 、
、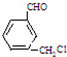 、还有
、还有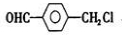 或
或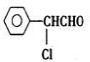 (任写一个合理结构).
(任写一个合理结构).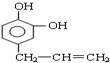 与溴水充分反应,需消耗4mol单质溴;
与溴水充分反应,需消耗4mol单质溴;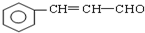 与氢气完全加成后的产物的结构简式
与氢气完全加成后的产物的结构简式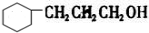 .
.