��Ŀ����
����Ŀ���ѹ���TiCl4�̳��к��д�����ScCl3��MgCl2��SiO2С���������ʣ�ij�о������������̳�����Sc2O3�����Ʊ��Ѱ�(TiO2)���乤������������ʾ��

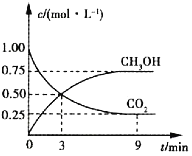
��1�����������HCl��������_______________________��
��2����֪Sc3++3HTBP![]() Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��___________(ѡ����ԡ��������ԡ������ԡ�)��Һ����ʵ����ģ���������������Ͳ��������漰�IJ���������______________��
Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��___________(ѡ����ԡ��������ԡ������ԡ�)��Һ����ʵ����ģ���������������Ͳ��������漰�IJ���������______________��
��3�����ᡰ���֡��õ������ֵĻ�ѧ��Ӧ����Ϊ____________________________��
��4���ڿ��������ղ����ּ��ɵõ�������(Sc2O3)���仯ѧ��Ӧ����ʽΪ__________________________��
��5����ˮ�ࡱ����Ҫ������TiOCl42-��H+��Cl- ��________��д�����������ˮ�����ȷ�����������ӷ�Ӧ����ʽ__________________________��
��6���ѵ�ұ���·��ǽ��ŵ�ⷨ������ͼ����
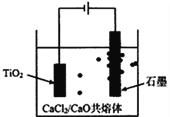
�Ժ�����CaCl2��CaO��������Ϊ���ʣ����ʱ�����������ɵ�Ca��һ����ԭTiO2���ѡ�д�������缫��Ҫ��Ӧ����ʽ��__________________________��������ѧ��ѧ֪ʶ����Ԥ��CaCl2�����ð�����ǿ�����ԡ�___________��F=96500C/mol����I=0.5A��ͨ��80���ӣ������ϻ��Ti������Ϊ__________g���������ʽ����
���𰸡�����TiOCl42-�Ľ�һ��ˮ�⣨���Mg2+��Sc3+ˮ������֣� ���� ��Һ©�����ձ� ���ֽⷴӦ 3O2+2Sc2��C2O4��3![]() 2Sc2O3+12CO2 Mg2+ TiOCl42-+��1+x��H2O
2Sc2O3+12CO2 Mg2+ TiOCl42-+��1+x��H2O![]() TiO2��xH2O+2H++4Cl- 2O2--4e-=O2�� ����CaO���۵�
TiO2��xH2O+2H++4Cl- 2O2--4e-=O2�� ����CaO���۵� ![]()
��������
(1)Ϊ�˷�ֹTiOCl42-��Mg2+��Se3+ˮ�⣬��������м���HCl���ԣ��ʴ�Ϊ������TiOCl42-�Ľ�һ��ˮ�⣻
(2)����Sc3++3HTBP![]() Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��������Һϴ�ӣ���������Sc3+��HTBP�ķ�Ӧ��������Ͳ�����Ϊ��Һ�����漰�IJ��������з�Һ©�����ձ����ʴ�Ϊ�����ԣ���Һ©�����ձ���
Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��������Һϴ�ӣ���������Sc3+��HTBP�ķ�Ӧ��������Ͳ�����Ϊ��Һ�����漰�IJ��������з�Һ©�����ձ����ʴ�Ϊ�����ԣ���Һ©�����ձ���
(3)ScCl3����ᷢ�����ֽⷴӦ���ɲ����֣��ʴ�Ϊ�����ֽⷴӦ��
(4)�ڿ��������ղ����ּ��ɵõ�������(Sc2O3)��ͬʱ��������ӱ��������ɶ�����̼����Ӧ�Ļ�ѧ��Ӧ����ʽΪ3O2+2Sc2(C2O4)3![]() 2Sc2O3+12CO2���ʴ�Ϊ��3O2+2Sc2(C2O4)3
2Sc2O3+12CO2���ʴ�Ϊ��3O2+2Sc2(C2O4)3![]() 2Sc2O3+12CO2��
2Sc2O3+12CO2��
(5)��������ͼ���ѹ���TiCl4�̳��к��д�����ScCl3��MgCl2��SiO2С���������ʣ�������˳�ȥ�˶������裬�����л��ܼ���ȡ����ˮ��������Ҫ������TiOCl42-��H+��Cl-��Mg2+����ˮ���м��������ˮ�����ȴٽ�TiOCl42-ˮ������TiO2��xH2O����Ӧ�����ӷ���ʽΪTiOCl42-+(1+x)H2O![]() TiO2��xH2O+2H++4Cl-���ʴ�Ϊ��Mg2+��TiOCl42-+(1+x)H2O
TiO2��xH2O+2H++4Cl-���ʴ�Ϊ��Mg2+��TiOCl42-+(1+x)H2O![]() TiO2��xH2O+2H++4Cl-��
TiO2��xH2O+2H++4Cl-��
(6)�������������Ʊ���ԭ����Ca������ԭ��Ca��һ����ԭTlO2����ѣ��缫��ӦΪCa2++2e-=Ca��2Ca+TlO2=2CaO+Ti������ʯī��������ʧȥ���������������缫��ӦʽΪ2O2--4e-=O2���������Ϊ�����Ȼ��Ƶ����ڵ������ƣ������Ȼ��ƿ�����ǿ����ʵĵ����ԣ�ͬʱ���Խ���CaO���۵㣬��Լ����������ǿ��Ϊ0.5A����ع���80���ӣ������Ϊ0.5A��80��60s=2400C��ת�Ƶ��ӵ����ʵ���=![]() ������Ti������=
������Ti������=![]() ��48g/mol=
��48g/mol=![]() ��48g���ʴ�Ϊ��2O2--4e-=O2��������CaO���۵㣻
��48g���ʴ�Ϊ��2O2--4e-=O2��������CaO���۵㣻![]() ��48��
��48��

 �����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӽݾ��㽭��ѧ������ϵ�д�����Ŀ������þ��Ϊԭ����ȡ������þ������ӡȾ����ֽ��ҽҩ�ȹ�ҵ����þ����һ�ֹ�ҵ���ϣ���Ҫ�ɷ���MgO(ռ40%)������CaO��MnO��Fe2O3��FeO��Al2O3��SiO2�����ʡ�����þ������ȡMgSO4��7H2O���������£�

(1)ʵ��������3 mol��L��1������500 mL������98%��Ũ����(����1.84 g��mL��1)�����ƣ���ȡŨ����ʱ����ʹ�õ���Ͳ�Ĺ��Ϊ ________(����ĸ)��
A��10 mL B��20 mL C��50 mL D��100 mL
(2)�����NaClO����Mn2����Ӧ������ʽΪMn2����ClO����H2O===MnO2����2H����Cl��,
��ʹ2moL Mn2����������������Ҫ������NaClO����Ϊ______g;����һ������Ҳ�ᱻNaClO�������÷�Ӧ�����ӷ���ʽΪ______________________________________��
(3)��������Ҫ�ɷֳ�����Fe(OH)3��Al(OH)3�⣬������________��_________��
(4)�ڡ����ơ�����ǰ����Ҫ������Һ���Ƿ���Fe2�����������鷽����_____________________________________��
(5)��֪MgSO4��CaSO4���ܽ�����±�(�ܽ�ȵ�λΪg/100 gˮ)��
�¶�/�� | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�����ơ��ǽ�MgSO4��CaSO4�����Һ�е�CaSO4��ȥ�������ϱ����ݣ���Ҫ˵�����ƵIJ������裺����Ũ����_________�����������ǽ���Һ��������Ũ������ȴ�ᾧ��__________����õ���MgSO4��7H2O��
(6)��ʵ�����ṩ����þ�100 g���õ���MgSO4��7H2OΪ86.1 g����MgSO4��7H2O�IJ���Ϊ__________��