题目内容
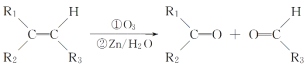
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
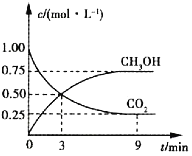
(1)3~9min内,v(H2)=_______mol·L-1·min-1。
(2)平衡时CO2的转化率为______。
(3)平衡时混合气体中CH3OH(g)的体积分数为______。
【答案】0.125 0.75% 30%
【解析】
(1)如图所示,3~9min内,v(H2)=3v(CO2)=![]() =0.125mol·L-1·min-1;
=0.125mol·L-1·min-1;
(2)平衡时CO2的转化率为![]() ;
;
(3)用三段式法进行数据分析知
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol) 1 3 0 0
反应(mol) 0.75 2.25 0.75 0.75
平衡(mol) 0.25 0.75 0.75 0.75
平衡时混合气体中CH3OH(g)的体积分数为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】N元素是植物生长的必需元素,含氮化合物在工农业生产以及生活中都发挥着重要作用。
(1)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为____。
(2)氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。某化学课外小组查阅资料后得知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快)ΔH1<0 K1
N2O2(g)(快)ΔH1<0 K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0 K2
2NO2(g)(慢)ΔH2<0 K2
反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)
2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
(3)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,v(N2O4)=__________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为____。改变温度至T1时k1=k