题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 CaCl2溶液中:Ag+、Cu2+、SCN-、![]()
B.能使甲基橙变红的溶液中:Na+、Mg2+、![]() 、Cl-
、Cl-
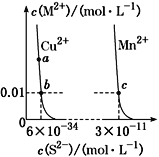
C.![]() =1×10-12 mol·L-1的溶液:K+、Na+、
=1×10-12 mol·L-1的溶液:K+、Na+、![]() 、
、![]()
D.0.1 mol·L-1 FeSO4溶液中:Na+、![]() 、ClO-、
、ClO-、![]()
【答案】C
【解析】
A. Cl-和Ag+会反应,不能大量共存,A选项不符合题意;
B. 能使甲基橙变红的溶液显酸性,![]() 不能大量共存,B选项不符合题意;
不能大量共存,B选项不符合题意;
C. ![]() =1×10-12 mol·L-1,溶液显碱性,无离子会反应,离子之间也不反应,所以能大量共存,C选项符合题意;
=1×10-12 mol·L-1,溶液显碱性,无离子会反应,离子之间也不反应,所以能大量共存,C选项符合题意;
D. Fe2+还原性强,能被ClO-、![]() 氧化,不能大量共存,D选项不符合题意;
氧化,不能大量共存,D选项不符合题意;
答案选C。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】Mn(H2PO4)2·2H2O是一种白色晶体,易溶于水,常用于机械设备的磷化处理。以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)为原料制备Mn(H2PO4)2·2H2O的流程如图:
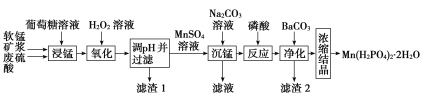
(1)软锰矿要先制成矿浆的目的是__,葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,该反应中氧化剂与还原剂的物质的量之比为__。
(2)用H2O2溶液“氧化”时发生反应的离子方程式为:__。
(3)已知几种金属离子的氢氧化物开始沉淀和完全沉淀的pH如表,“调pH并过滤”时,应调整的pH范围为__,滤渣1的主要成分为__(填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(4)加入磷酸后发生反应的化学方程式为__。
(5)某工厂用上述流程制备Mn(H2PO4)2·2H2O,已知软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,则1吨该软锰矿可制得Mn(H2PO4)2·2H2O__t。