题目内容
12.下列微粒中不具有正四面体结构的是( )| A. | NH4+ | B. | 金刚石 | C. | 甲烷 | D. | H2O |
分析 分子或离子的结构可以根据价层电子对互斥理论确定,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,;常见的单质可以根据其结构图分析.
NH4+中价层电子对个数=σ键个数+孤电子对个数=4+0=4,所以氮原子杂化方式是sp3;
金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,所以每个碳原子的价层电子对是4,则碳原子采取sp3杂化;
CH4分子中碳原子sp3杂化,没有弧对电子对;
H2O分子中氧原子sp3杂化,有两对弧对电子对.
解答 解:A、NH4+中价层电子对个数=σ键个数+孤电子对个数=4+0=4,所以氮原子杂化方式是sp3,为正四面体结构,故A不选;
B、金刚石中每个碳原子和4个碳原子以σ键相结合,且没有孤对电子,碳原子采取sp3杂化,构型为正四面体结构,故B不选;
C、CH4中中心原子价层电子对个数为4,4个共价键完全相同,碳原子采用sp3杂化,则其分子结构为四面体结构,故C不选;
D、H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以O原子采用sp3杂化,有两对弧对电子对,所以分子构型为V型,故D选;
故选:D.
点评 本题考查了分子的空间构型的判断,注意把握价层电子对互斥理论的应用,明确晶体结构是解此题关键,注意理解熟记常见分子的空间构型,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.短周期元素A、B可形成A3B2型化合物,若B的原子序数为 b,则A的原子序数不可能为( )
| A. | b+1 | B. | b+5 | C. | b+4 | D. | b-11 |
3.下列物质中属于高分子化合物的是( )
①油脂②蔗糖③淀粉④丙氨酸⑤蛋白质⑥聚氯乙烯⑦乙酸乙酯⑧纤维素.
①油脂②蔗糖③淀粉④丙氨酸⑤蛋白质⑥聚氯乙烯⑦乙酸乙酯⑧纤维素.
| A. | ①③⑤⑥ | B. | ③⑤⑥⑧ | C. | ②④⑦ | D. | 除②④⑦外 |
20.短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族.则下列叙述正确的是( )
| A. | 原子半径:A<B<C | |
| B. | B与A的化合物比A与C 的化合物熔点低 | |
| C. | 氢化物稳定性:A<C | |
| D. | A与C的化合物属于大气污染物 |
4.下列反应的离子方程式中,不正确的是( )
| A. | 碳酸钠溶液中加入足量的乙酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 向氨基乙酸溶液中滴入NaOH溶液:H2NCH2COOH+OH-→H2NCH2COO-+H2O | |
| D. | 向氯化铁溶液中加入足量的铁:2Fe3++Fe=3Fe2+ |
1.化学与日常生活紧密相关,下列说法错误的是( )
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 装饰材料释放的甲醛会造成污染 |
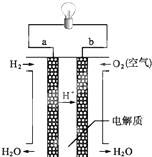 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.