题目内容
20.短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族.则下列叙述正确的是( )| A. | 原子半径:A<B<C | |
| B. | B与A的化合物比A与C 的化合物熔点低 | |
| C. | 氢化物稳定性:A<C | |
| D. | A与C的化合物属于大气污染物 |
分析 A原子次外层电子数等于B原子最外层电子数,则B的最外层电子数为2,根据它们的原子的最外层电子数之和为14.A与C在周期表中同主族,可知A、C的最外层电子数为6,分别为O元素、S元素,A、B、C原子序数依次递增,则B为Mg元素,结合元素周期律解答该题,并以此来解答.
解答 解:A原子次外层电子数等于B原子最外层电子数,则B的最外层电子数为2,根据它们的原子的最外层电子数之和为14.A与C在周期表中同主族,可知A、C的最外层电子数位6,分别为O元素、S元素,A、B、C原子序数依次递增,则B为Mg元素,
A.同主族元素从上到下原子半径逐渐增大,同周期元素从左到右原子半径逐渐减小,则原子半径Mg>S>O,故A错误;
B.B与A的化合物为MgO,为离子化合物,A与C的化合物为SO2,为共价化合物,为分子晶体,则MgO熔点高,故B错误;
C.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,所以氢化物稳定性:A>C,故C错误;
D.A与C的化合物为二氧化硫,可导致酸雨,属于大气污染物,故D正确.
故选D.
点评 本题考查原子结构与元素周期律的关系,注意根据原子结构特点判断元素的种类为解答该题的关键,把握元素周期律的递变规律,题目难度不大,本题注意晶体类型的区别.

练习册系列答案
相关题目
10.设NA为阿伏伽德罗常数,下列说法不正确的是( )
| A. | 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6gNa与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6gNa2CO3晶体中含CO32-数目为0.1NA | |
| D. | 常温下,22gCO2含碳氧双键数目为NA |
11.下列有关碳和碳的化合物的说法中,错误的是( )
| A. | 金刚石和石墨物理性质不同,是因为它们的碳原子排列方式不同 | |
| B. | 一氧化碳、二氧化碳、葡萄糖都属于有机物 | |
| C. | 木炭、一氧化碳在一定条件下都能与氧化铜反应 | |
| D. | 大气中二氧化碳的消耗途径主要是绿色植物的光合作用 |
15.已知在相同状况下,同一化学键断裂需要吸收的能量等于形成该化学键放出的能量.下列说法正确的是( )
| A. | 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应 | |
| B. | 水分解产生氢气和氧气时放出能量 | |
| C. | 相同状况下,反应2SO2+O2═2SO3是一个放热反应,则反应2SO3═2SO2+O2是一个吸热反应 | |
| D. | 氯化氢分解成氢气和氯气时能够放出能量 |
5.下列各含氧酸中酸性最强的是( )
| A. | HClO2 | B. | H2SO4 | C. | H2SO3 | D. | HClO4 |
12.下列微粒中不具有正四面体结构的是( )
| A. | NH4+ | B. | 金刚石 | C. | 甲烷 | D. | H2O |
10.下列说法正确的是( )
| A. | 糖类、油脂和蛋白质是基本营养物质,它们都是天然高分子化合物 | |
| B. | 蛋白质水解的最终产物是多肽 | |
| C. | 米酒变酸的过程涉及了氧化反应 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
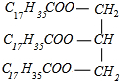 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+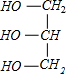 .列式计算将所生成的硬脂酸钠制成含硬脂酸钠质量分数为50%的肥皂多少吨?20.2t.
.列式计算将所生成的硬脂酸钠制成含硬脂酸钠质量分数为50%的肥皂多少吨?20.2t.