题目内容
【题目】25°C 时,向 20 mL 0.10 molL-1的一元酸 HA 中逐滴加入 0.10 molL-1 NaOH 溶液,溶液 pH随加入 NaOH 溶液体积的变化关系如图所示。下列说法正确的是( )

A.HA为强酸
B.a点溶液中,c(A-)>c(Na+)>c(H+)>c(OH-)
C.酸碱指示剂可以选择甲基橙或酚酞
D.b点溶液中,c(Na+)=c(A-)
【答案】D
【解析】
A、根据图示可知,加入20mL等浓度的氢氧化钠溶液时,二者恰好反应生成NaA,溶液的pH>7,说明NaA为强碱弱酸盐,则HA为弱酸,故A错误;
B、a点反应后溶质为NaA,A-部分水解溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(Na+)>c(A-),溶液中离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(H+),故B错误;
C、根据图示可知,滴定终点时溶液呈碱性,甲基橙的变色范围为3.1~4.4,酚酞的变色范围为8~10,指示剂应该选用酚酞,不能选用甲基橙,故C错误;
D、b点溶液的pH=7,呈中性,则c(OH-)=c(H+),根据电荷守恒可知:c(Na+)=c(A-),故D正确;
故选:D。

 阅读快车系列答案
阅读快车系列答案【题目】“中和滴定原理在实际生产生活中应用广泛某化学学习小组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资和网络查寻,得知草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
回答下列问题:
(1)该滴定实验所需的玻璃仪器有______。
A.酸式滴定管(50mL) B.碱式滴定管(50mL) C.量筒(50mL) D.锥形瓶 E.烧杯
(2)滴定终点的现象为_____________________________________________________。
(3)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.100mol·L-1KMnO4的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 滴液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度______________。(计算结果保留四位有效数字)
(4)讨论:若滴定到终点时俯视滴定管刻度线读数,则由此测得的x值会______________(填“偏大”、“偏小”或“不变”)。
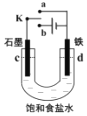
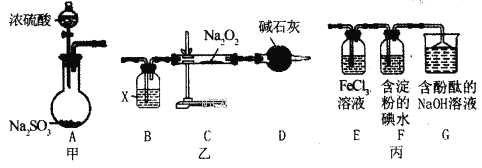
【题目】某兴趣小组运用如图所示组合装置(部分夹持装置未画出)进行探究实验。
请回答下列问题:
(1)A同学将甲、乙装置组合进行实验,其实验目的是探究__反应的生成物;在连接好装置后,首先要进行的实验操作为___。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为__,装置D中碱石灰的作用是__;
(3)B同学将甲、丙装置组合进行实验,能说明I-的还原性弱于SO2的现象为__,发生反应的离子方程式是__。
(4)装置G中的现象是__,说明SO2具有__性。
(5)为验证装置E中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | 产生白色沉淀 | SO2与FeCl3发生了氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | ___ |
【题目】利用如图装置测定中和热的实验步骤如下:
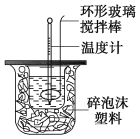
①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): ______。
(2)倒入NaOH溶液的正确操作是________(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选出)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ____________________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验测量结果得出的中和热的数值与57.3 kJ/mol相比偏小,产生的原因可能是(填字母)_________。
a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度