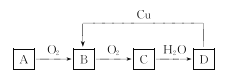
题目内容
【题目】酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂,用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2===K2SO4+2MnSO4+5O2↑+8H2O,当有6 mol H2SO4参加反应,有________mol还原剂被氧化。
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为__________________________
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色,溶液先变为浅绿色的离子方程式是_______________ ,再变为棕黄色的原因是_______________
【答案】10 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ 酸性条件下NO3-将Fe2+氧化成Fe3+
【解析】
(1)用双线桥分析反应,根据物质的量之间的关系计算。
(2)酸性条件下MnO4-被还原成Mn2+,H2C2O4被氧化成CO2,根据得失电子守恒、原子守恒、电荷守恒配平书写离子方程式。
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色;溶液先变为浅绿色,因为SO32-具有还原性,SO32-将Fe3+还原为Fe2+,自身被氧化为SO42-;再变为棕黄色,说明酸性条件下NO3-将Fe2+氧化成Fe3+;据此分析作答。
(1)用双线桥分析反应为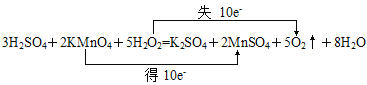 ,反应中H2O2为还原剂,每3molH2SO4参与反应将有5molH2O2被氧化,则6molH2SO4参与反应有10molH2O2被氧化。
,反应中H2O2为还原剂,每3molH2SO4参与反应将有5molH2O2被氧化,则6molH2SO4参与反应有10molH2O2被氧化。
(2)酸性条件下MnO4-被还原成Mn2+,H2C2O4被氧化成CO2,反应可写成MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O,1mol MnO4-反应得到5mol电子,1mol H2C2O4反应失去2mol电子,根据得失电子守恒配平为2MnO4-+5H2C2O4+H+→2Mn2++10CO2↑+H2O,结合原子守恒、电荷守恒,离子方程式为2MnO4-+5H2C2O4+6H+=Mn2++10CO2↑+8H2O。
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,再变为棕黄色;溶液先变为浅绿色,因为SO32-具有还原性,SO32-将Fe3+还原为Fe2+,自身被氧化为SO42-,反应的离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;再变为棕黄色,说明酸性条件下NO3-将Fe2+氧化成Fe3+,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。