题目内容
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
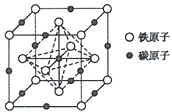
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。
【答案】第四周期、第VIII族; ![]() ; sp2;
; sp2; ![]() ; 因为分解后生成的FeO和CoO中,FeO的晶格能更大; 6; 12;
; 因为分解后生成的FeO和CoO中,FeO的晶格能更大; 6; 12; ![]() ;
;
【解析】
(1)根据构造原理得出基态原子价电子排布图;
(2)根据孤电子对数,价层电子对数的相关知识解答。
(3)根据晶格能判断;
(4)根据配合物及配合物的配位数的相关计算解答;
(5)根据晶胞结构以及用均摊法晶胞求解。
(1)Co在元素周期表中位于第4周期第VIII族。根据构造原理,其基态原子价电子排布图为![]() 。
。
(2)CO32-中C的孤电子对数为![]() ×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C为sp2杂化。CO32-中参与形成大π键的原子数是4个,电子数是6个,则CO32-中大π键可表示为
×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C为sp2杂化。CO32-中参与形成大π键的原子数是4个,电子数是6个,则CO32-中大π键可表示为![]() 。
。
(3)在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,原因是:Fe2+半径为61pm,Co2+半径为65pm,Fe2+的离子半径小于Co2+的离子半径,FeO的晶格能大于CoO的晶格能。
(4)向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g,n(AgCl)=2.87g÷143.5g/mol=0.02mol,即配合物中2个Cl-在外界,1个Cl-在内界,则该配合物可表示为[Co(NH3)5Cl]Cl2,该配合物的配位数为6。
(5)根据晶胞结构知,该晶体中与铁原子距离最近的铁原子数目为12个。用均摊法晶胞中含Fe:8×![]() +6×
+6×![]() =4,C:12×
=4,C:12×![]() +1=4,该晶体的化学式为FeC,该晶体的密度为
+1=4,该晶体的化学式为FeC,该晶体的密度为![]() g÷(a×10-10cm)3=
g÷(a×10-10cm)3=![]() g/cm3。
g/cm3。

 名校课堂系列答案
名校课堂系列答案【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
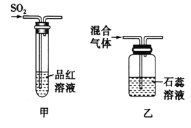
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
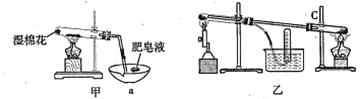
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。