题目内容
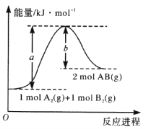
【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两种元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M层的电子数之和。
(1)A为________________(填元素名称,下同), C为___________;
(2)写出E的电子式_______________。
(3)A、B的一种化合物与E反应的化学方程式为_______________________;
(4)A、B两种元素形成的化合物属于____________(填“离子”或“共价”)化合物;
(5)D的最高价氧化物对应的水化物的浓溶液和A的单质反应的化学方程式为______________。
【答案】碳 钠 ![]() 2Na2O2+2CO2 =2Na2CO3+O2 共价 C+2H2SO4(浓)
2Na2O2+2CO2 =2Na2CO3+O2 共价 C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
【解析】
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层有4个电子,判断为C或硅,B的阴离子和C的阳离子有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,为过氧化钠,判断B为O,C为Na,D的L层电子数等于K、M两个电子层上的电子数之和,则判断为S,据此分析回答问题。
综上所述得到A、B、C和D分别为:C、O、Na、S,则
(1)A的元素名称为碳,C为钠;
(2)E为过氧化钠,其电子式为![]() ;
;
(3)A、B的化合物为二氧化碳,E为过氧化钠,二氧化碳与过氧化钠反应的化学方程式为:2Na2O2+2CO2 =2Na2CO3+O2;
(4)A、B两元素形成的化合物为二氧化碳,属于共价化合物,故答案为:共价;
(5)D的最高价氧化物的水化物为硫酸,A为碳,则浓硫酸和碳反应的化学方程式为:C+2H2SO4(浓) ![]() CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。

 全能闯关100分系列答案
全能闯关100分系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大:_____min(填0~1、1~2、2~3、3~4、4~5),原因是________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________ (设溶液体积不变)。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
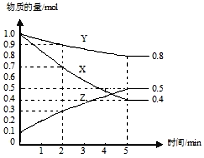
①该反应的化学方程式是___________。
②该反应达到平衡状态的标志是________
A.X的浓度不再改变
B.生成1mol Y的同时消耗2mol Z
C.Y的体积分数在混合气体中保持不变
D.容器内气体的总质量保持不变
③2min内Y的转化率为_________。