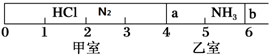
题目内容
6.标准状况下,将a L SO2和Cl2组成的混合气体通入100mL 0.1mol•L-1Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅.向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65g.则下列关于该过程的推断不正确的是( )| A. | 所得沉淀为0.05 mol的BaSO4 | B. | 混合气体中SO2的体积为0.448L | ||
| C. | a L混合气体的物质的量为0.04mol | D. | a的取值范围为0.672<a<0.896 |
分析 SO2和Cl2组成的混合气体通入Fe2(SO4)3溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO2+Cl2+2H2O=2HCl+H2SO4,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫:2Fe3++SO2+H2O=SO42-+2Fe2++2H+,二氧化硫完全反应,反应后的溶液足量的BaCl2溶液,生成的11.65g沉淀为BaSO4,
A.根据分析可知硫酸钡的物质的量为0.05mol;
B.根据硫元素守恒可知n(BaSO4)=3n[Fe2(SO4)3]+n(SO2),据此计算n(SO2),然后计算出标况下二氧化硫的体积;
C.由于硫酸铁氧化二氧化硫,100mL0.1mol•L-1Fe2(SO4)3溶液中含有0.02mol铁离子,根据反应可知0.02mol铁离子能够氧化0.01mol二氧化硫,剩余的0.01mol二氧化硫需要氯气氧化,所以氯气至少有0.01mol、最多为0.02mol,据此计算出a的范围;
D.根据C的分析结果进行判断.
解答 解:SO2和Cl2组成的混合气体通入Fe2(SO4)3溶液中,由于氯气的氧化性强于铁离子,故氯气先与二氧化硫反应:SO2+Cl2+2H2O=2HCl+H2SO4,充分反应后,溶液的棕黄色变浅,说明铁离子氧化二氧化硫:2Fe3++SO2+H2O=SO42-+2Fe2++2H+,二氧化硫完全反应,反应后的溶液足量的BaCl2溶液,生成的11.65g沉淀为BaSO4,其物质的量为:n(BaSO4)=$\frac{11.65g}{233g/mol}$=0.05mol,根据硫元素守恒可知n(BaSO4)=3n[Fe2(SO4)3]+n(SO2),故n(SO2)=0.05mol-3×0.1L×0.1mol•L-1=0.02mol,
A.B.根据分析可知,生成的11.65g沉淀为BaSO4,其物质的量为0.05mol,故A正确;
B.根据上述分析可知,V(SO2)=0.02mol×22.4L/mol=0.448L,故B正确;
C.由上述分析可知,V(SO2)=0.02mol×22.4L/mol=0.448L,由于硫酸铁氧化二氧化硫,根据方程式可知n(Cl2)<n(SO2),故n(Cl2)<0.02mol,故V(Cl2)<0.02mol×22.4L/mol=0.448L;又由于被氧化的二氧化硫为0.02mol,而100mL0.1mol•L-1Fe2(SO4)3溶液中含有0.01mol硫酸铁,含有0.02mol铁离子,根据反应2Fe3++SO2+H2O=SO42-+2Fe2++2H+可知,0.02mol铁离子最多氧化0.01mol二氧化硫,剩余的0.01mol二氧化硫需要0.01mol氯气氧化,所以氯气的物质的量最少为0.01mol,标况下0.01mol氯气的体积为0.224L,则混合气体最小体积为:0.448L+0.224L=0.672L,故a的取值范围为0.672<a<0.896,故C错误;
D.根据C可知,a的取值范围为:0.672<a<0.896,故D正确;
故选C.
点评 本题考查混合物的有关计算,题目难度中等,根据现象判断发生的反应是关键,题目侧重对化学计算解题技巧与思维能力考查,注意利用守恒思想进行的计算.

 口算题天天练系列答案
口算题天天练系列答案| A. | 液态HBr不导电,因此HBr是非电解质 | |
| B. | 自由移动离子数目多的电解质溶液导电能力不一定强 | |
| C. | CO2的水溶液能导电,因此CO2是电解质 | |
| D. | NaHSO4在水溶液及熔融状态下均可电离成Na+、H+、SO42- |
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 8:53 |
| A. | 试管 | B. | 酒精灯 | C. | 试管夹 | D. | 集气瓶 |
| A. | AB3 | B. | AB | C. | A3B | D. | A3B2 |
| A. | 50 mL 1.5 mol•L-1的FeCl2溶液 | B. | 100 mL 3 mol•L-1的NH4Cl溶液 | ||
| C. | 75 mL 3 mol•L-1的KCl溶液 | D. | 50 mL 2 mol•L-1的CaCl2溶液 |
| A. | 放热反应不需要加热就可以发生 | |
| B. | 反应条件为加热的反应都是吸热反应 | |
| C. | 化学反应放热还是吸热,取决于反应条件 | |
| D. | 化学反应除了生成新物质外,还伴随着能量的变化 |