题目内容
13.下列反应不属于氧化还原反应的是( )| A. | 2H2O2=2H2O+O2↑ | B. | 2Na+2H2O=2NaOH+H2↑ | ||
| C. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | D. | 3CO+Fe2O3=2Fe+3CO2 |
分析 发生的反应中,含元素的化合价变化,则为氧化还原反应;若不含元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.2H2O2=2H2O+O2↑,O元素的化合价变化,为氧化还原反应,故A不选;
B.2Na+2H2O=2NaOH+H2↑,Na、H元素的化合价变化,为氧化还原反应,故B不选;
C.CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,没有元素的化合价变化,不属于氧化还原反应,故C选;
D.3CO+Fe2O3=2Fe+3CO2,C、Fe元素的化合价变化,为氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
相关题目
4.25℃,pH=5的HCl和pH=9的NaOH溶液以体积比11:9混合,混合液的pH为( )
| A. | 7.2 | B. | 8 | C. | 6 | D. | 7 |
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | pH=1的溶液中:Ca2+、Fe2+、NO3-、CO32- | |
| B. | $\frac{K}{c(OH^{-})}$=10-2mol/L的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(Fe3+)=0.1mol/L的溶液中:K+、SCN-、SO42-、Cl- | |
| D. | 由水电离的$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-14mol/L的溶液中:Na+、AlO2-、HCO3-、OH- |
8.在pH=1的无色溶液中,下列各离子组因发生氧化还原反应而不能共存的是( )
| A. | NH4+ K+ Na+ CO32- NO3- | B. | K+ Na+ Fe2+ SO42- NO3- | ||
| C. | NH4+ K+ Na+ HCO3-[Al(OH)4]- | D. | NH4+ K+ Na+ NO3- I- |
18.下列反应中需加入还原剂才能进行的是( )
| A. | Cl2→ClO- | B. | Zn→Zn2+ | C. | H+→H2 | D. | CuO→CuCl2 |
2.下列有关胶体的叙述中不正确的是( )
| A. | 淀粉溶胶中混有的氯化钠可以利用渗析的方法除去 | |
| B. | 向氢氧化铁胶体中逐滴滴入硫酸溶液,可以观察到先出现红褐色沉淀而后沉淀溶解形成澄清溶液 | |
| C. | 胶体介稳的主要原因是胶体带有电荷 | |
| D. | 可以利用丁达尔效应来鉴别胶体和溶液 |
3.下列粒子对H2O的电离平衡不产生影响的是( )
| A. | CH3COOH | B. | 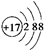 | C. | Fe3+ | D. | NH3•H2O |
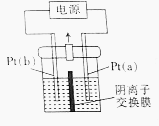 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.