题目内容
(1)同温同压下,同体积的甲烷(CH4)和CO2气体的分子数之比为______;质量比为______;原子总数之比为______;氢原子数与氧原子数之比为______.
(2)已知N2、CO2的混合气体的质量共12.0克,标准状况下,体积为6.72L,该混合气体的平均摩尔质量为______;原混合气体中N2、CO2的体积之比为______.
解:(1)同温同压下,同体积,则气体的物质的量相同,气体的分子数相同,则甲烷(CH4)和CO2气体的分子数之比为1:1,
设它们的物质的量都是nmol,
则质量比为nmol×16g/mol:nmol×44g/mol=4:11,
原子总数之比为nmol×5:nmol×3=5:3,
氢原子数与氧原子数之比为nmol×4:nmol×2=2:1,
故答案为:1:1;4:11;5:3;2:1;
(2)标准状况下,体积为6.72L,则混合气体的物质的量为 =0.3mol,
=0.3mol,
混合气体的平均摩尔质量为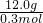 =40g/mol,
=40g/mol,
设混合气体中N2的物质的量为x,CO2的物质的量为y,则
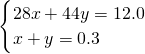 ,解得x=0.075mol,y=0.225mol,
,解得x=0.075mol,y=0.225mol,
则原混合气体中N2、CO2的体积之比为0.075mol:0.225mol=1:3,
故答案为:40g/mol;1:3.
分析:(1)同温同压下,同体积,则气体的物质的量相同,气体的分子数相同,利用m=n×M来计算质量之比,利用分子的构成来计算原子总数之比、原子数之比;
(2)标准状况下,气体的体积之比等于物质的量之比,设出它们的物质的量,利用质量、物质的量列关系式来解答.
点评:本题考查阿伏伽德罗定律及物质的量的有关计算,明确质量与物质的量的关系、体积与物质的量的关系是解答本题的关键.
设它们的物质的量都是nmol,
则质量比为nmol×16g/mol:nmol×44g/mol=4:11,
原子总数之比为nmol×5:nmol×3=5:3,
氢原子数与氧原子数之比为nmol×4:nmol×2=2:1,
故答案为:1:1;4:11;5:3;2:1;
(2)标准状况下,体积为6.72L,则混合气体的物质的量为
 =0.3mol,
=0.3mol,混合气体的平均摩尔质量为
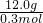 =40g/mol,
=40g/mol,设混合气体中N2的物质的量为x,CO2的物质的量为y,则
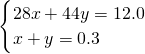 ,解得x=0.075mol,y=0.225mol,
,解得x=0.075mol,y=0.225mol,则原混合气体中N2、CO2的体积之比为0.075mol:0.225mol=1:3,
故答案为:40g/mol;1:3.
分析:(1)同温同压下,同体积,则气体的物质的量相同,气体的分子数相同,利用m=n×M来计算质量之比,利用分子的构成来计算原子总数之比、原子数之比;
(2)标准状况下,气体的体积之比等于物质的量之比,设出它们的物质的量,利用质量、物质的量列关系式来解答.
点评:本题考查阿伏伽德罗定律及物质的量的有关计算,明确质量与物质的量的关系、体积与物质的量的关系是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

