题目内容
(1)下列物质中:①NaCl溶液 ②氢氧化钠 ③二氧化碳 ④金刚石 ⑤水 ⑥酒精,属于电解质的是
(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是
g.
②⑤
②⑤
;非电解质的是③⑥
③⑥
.(请用序号填空)(2)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为
1:1
1:1
,物质的量之比为1:1
1:1
,原子总数之比为5:3
5:3
;质量之比为4:11
4:11
,密度之比为4:11
4:11
.(3)若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是
| M |
| NA |
| M |
| NA |
分析:(1)在水溶液里或熔融状态下能导电的化合物是电解质;在水溶液里和熔融状态下都不导电的化合物是非电解质;混合物和单质既不是电解质也不是非电解质;
(2)同温同压下,相同体积的气体物质的量相同,根据物质的量和分子组成计算原子个数关系,根据物质的量和气体的摩尔质量计算质量和密度关系;
(3)根据1mol任何微粒的数目均为 NA个,结合阿伏加德罗常数的含义来计算;
(2)同温同压下,相同体积的气体物质的量相同,根据物质的量和分子组成计算原子个数关系,根据物质的量和气体的摩尔质量计算质量和密度关系;
(3)根据1mol任何微粒的数目均为 NA个,结合阿伏加德罗常数的含义来计算;
解答:解:(1)①NaCl溶液是氯化钠和水组成的溶液,是混合物,既不是电解质,也不是非电解质;
②氢氧化钠在水溶液里或熔融状态下能电离出自由移动的钠离子和氢氧根离子导电,是电解质;
③CO2的水溶液能导电,是因二氧化碳和水反应生成碳酸,碳酸电离生成离子而导电,即发生电离不是CO2本身,故CO2属于非电解质;
④金刚石是碳元素的单质,既不是电解质,也不是非电解质;
⑤水的电离H2O?H++OH-,所以水是电解质;
⑥酒精常温下呈液态,在水溶液里只存在乙醇分子不导电,是非电解质;
故答案为:②⑤、③⑥;
(2)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1;
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3;
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
体积相同,则密度之比等于物质的质量之比,也为4:11;
故答案为:1:1;1:1;5:3;4:11;4:11;
(3)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数NA个,即NA个原子的质量是Mg,
则一个该原子的真实质量约为:
;
故答案为:
;
②氢氧化钠在水溶液里或熔融状态下能电离出自由移动的钠离子和氢氧根离子导电,是电解质;
③CO2的水溶液能导电,是因二氧化碳和水反应生成碳酸,碳酸电离生成离子而导电,即发生电离不是CO2本身,故CO2属于非电解质;
④金刚石是碳元素的单质,既不是电解质,也不是非电解质;
⑤水的电离H2O?H++OH-,所以水是电解质;
⑥酒精常温下呈液态,在水溶液里只存在乙醇分子不导电,是非电解质;
故答案为:②⑤、③⑥;
(2)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1;
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3;
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
体积相同,则密度之比等于物质的质量之比,也为4:11;
故答案为:1:1;1:1;5:3;4:11;4:11;
(3)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数NA个,即NA个原子的质量是Mg,
则一个该原子的真实质量约为:
| M |
| N A |
故答案为:
| M |
| N A |
点评:本题考查了电解质和非电解质概念的判断,考查了物质的量的有关计算,以及阿伏伽德罗定律及推论,注意把握物质的量、质量、体积之间的计算公式的运用是解答本题(2)的关键,题目难度中等.

练习册系列答案
相关题目
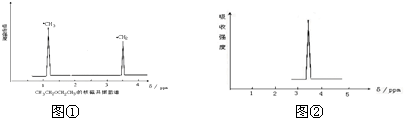

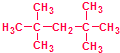
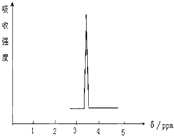 利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖.
利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖. ③白磷 ④氯气
③白磷 ④氯气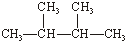 ⑥氯水 ⑦12C
⑥氯水 ⑦12C 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.