题目内容
20.某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:Ⅰ.分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),搅拌,测量温度 为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10mL 密度约为1.1g/mL 20%的盐酸(20℃),搅拌,测量温度T3.
得到下表的数据:
| 温度 试剂 | T1/℃ | T2/℃ | T2/℃ |
| Ha2CO2 | 23.3 | 20.0 | 23.7 |
| HaCO2 | 18.5 | 20.0 | 20.8 |
(1)NaHCO3溶于水显碱性,其原因是HCO3-+H2O?H2CO3+OH-(用离子方程式表示).
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体能否全部溶解是(填“是”或“否”).
(3)分析表1的数据得出:Na2CO3固体溶于水放热,NaHCO3固体溶于水吸热(填“放热”或“吸热”).
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应.乙同学认为应该增加一个实验,并补做如下实验:向 盛 有10mL水(20℃)的烧杯中加入10mL密度约为1.1g/mL20%的盐酸(20℃),搅拌,测量温度为22.2℃.
(5)结合上述探究,下列说法正确的是AC.
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,设计了如下实验方案,其中不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是C
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体.
若按A方案进行实验,则原混合物中NaHCO3的质量分数为$\frac{84b}{31a}$×100%(用含a、b的代数式表示)
附表:溶解度表
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Ha2CO2 | 12.5g | 21.5g | 39.7g | 40.g |
| HaHCO2 | 8.1g | 9.6g | 11.1g | 12.7 |
分析 (1)碳酸氢钠溶液中,碳酸氢根离子部分水解,溶液呈碱性;
(2)10mL水的质量约为10g,结合表中20℃时碳酸钠、碳酸氢钠的溶解度进行判断;
(3)根据碳酸钠、碳酸氢钠溶解后表中温度T1与室温大小进行判断;
(4)10mL 20%的盐酸(20℃)溶于水是放热还是吸热,影响碳酸钠、碳酸氢钠与盐酸反应的能量变化;
(5)A.相同浓度和体积的盐酸溶于水后温度为22.2℃,而NaHCO3与盐酸的反应后温度变为20.8℃,反应后温度降低说明碳酸氢钠与盐酸的反应是吸热反应;
B.碳酸钠、碳酸氢钠分别与相同浓度的盐酸反应的现象不同,可以用盐酸鉴别碳酸钠和碳酸氢钠;
C.根据实验可知,Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关;
(6)A.此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
B.根据钠守恒,可列方程组求解;
C.应先把水蒸气排除才合理;
D.根据质量关系,可列方程组求解;
碳酸钠性质稳定,加热不分解,碳酸氢钠热稳定性较差,加热分解导致固体质量减少,根据固体质量变化利用差量法可以计算出混合物中碳酸氢钠的质量,再计算出碳酸氢钠的质量及质量分数即可.
解答 解:(1)碳酸氢钠溶液中,碳酸氢根离子部分水解:HCO3-+H2O?H2CO3+OH-,导致溶液呈碱性,故答案为:碱;HCO3-+H2O?H2CO3+OH-;
(2)20℃时碳酸钠的溶解度为21.5g,碳酸氢钠的溶解度为9.6g,则分别向盛有0.5g Na2CO3固体、0.5gNaHCO3固体的烧杯中加入10mL水(20℃),10mL水的质量约为10g,在该温度下最多能够溶解2.15g碳酸钠、0.96g碳酸钠,所以碳酸钠和碳酸氢钠都能够完全溶解,
故答案为:是;
(3)根据表中数据可知,碳酸钠溶解后溶液温度升高,说明碳酸钠溶于水放热;碳酸氢钠溶解后溶液温度降低,说明碳酸氢钠溶于水吸热,
故答案为:放热;吸热;
(4)10mL 密度约为1.1g/mL 20%的盐酸(20℃)溶于水的反应热会影响碳酸钠、碳酸氢钠与盐酸反应的能量变化,所以需要补充实验:向盛有10mL水(20℃)的烧杯中加入10mL 密度约为1.1 g/mL 20%的盐酸(20℃),分析温度变化,
故答案为:密度约为1.1 g/mL 20%的盐酸(20℃);
(5)A.同样浓度的盐酸溶于水后温度为22.2℃,而NaHCO3与盐酸的反应后温度变为 20.8℃,说明碳酸氢钠与盐酸的反应是吸热反应,故A正确;
B.碳酸钠与盐酸先反应生成碳酸氢钠,然后碳酸氢钠再与盐酸反应生成二氧化碳气体,而碳酸氢钠中加入盐酸后立刻生成二氧化碳,可用稀盐酸鉴别Na2CO3和NaHCO3固体,故B错误;
C.根据实验可知,Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,不能直接根据反应温度判断,故C正确;
故答案为:AC;
(6)A.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故A错误;
B.Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,故B错误;
C.混合物与足量稀硫酸充分反应,也会生成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故C正确;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D错误;
加热过程中碳酸钠不变,碳酸氢钠分解,反应的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
反应前后固体质量变化为:bg,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ 减少的固体质量△m
168 106 62
m(NaHCO3) bg
则:m(NaHCO3)=$\frac{168×bg}{62}$=$\frac{84}{31}$bg,
所以该样品中碳酸氢钠的质量分数为:$\frac{\frac{84}{31}bg}{ag}$×100%=$\frac{84b}{31a}$×100%,
故答案为:C; $\frac{84b}{31a}$×100%.
点评 本题考查了物质性质的分析,该题以碳酸钠与碳酸氢钠的性质比较为载体,侧重于化学实验方案的评价,题目难度中等,注意把握碳酸钠、碳酸氢钠的性质以及实验方案的原理.

| A. | 体系的压强不再发生变化 | |
| B. | V正(CO)=V逆(H2O) | |
| C. | 体系的气体的密度和平均相对分子质量不再发生变化 | |
| D. | 1 mol H-H键断裂的同时生成2 mol H-O键 |
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.2NA | |
| B. | 标准状况下 11.2 L NO与11.2L O2混合,充分反应后所含分子数为0.75NA | |
| C. | 标准状况下,22.4 LCO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
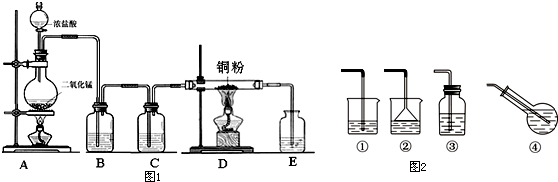
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移情况:
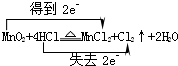 .
.(2)B瓶盛放的试剂是饱和食盐水(填名称),其作用是除去HCl;C瓶盛放的试剂是浓硫酸(填名称),其作用是干燥Cl2;
(3)实验开始时,应首先检验装置的气密性;实验结束应先熄灭D处的酒精灯;
(4)写出D处管内反应的化学方程式:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2;
Ⅱ、(1)若制备饱和氯水,图2吸收装置中最佳的选择是④;
(2)用滴管将新制氯水慢慢滴入含酚酞的NaOH溶液中,当滴到最后一滴时,红色褪去.产生上述现象的可能原因有两种:①氯水显酸性,NaOH溶液被中和而褪色;②氯水中的HClO将酚酞氧化而褪色.请你帮他设计实验证明红色褪去的原因是①还是②.
| 实验操作 | 实验现象 | 结 论 |
| 向已褪色的溶液中加入适量NaOH溶液 | 溶液变红 | 假设①成立 |
| 溶液不变红 | 假设②成立 |
 乙苯
乙苯 2,3-二甲基戊烷
2,3-二甲基戊烷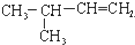 3-甲基-1-丁烯
3-甲基-1-丁烯 .
.

