题目内容
用如图装置实验,下列叙述不正确的是( )
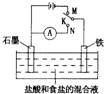

| A、K与N连接时,组成原电池装置 |
| B、K与N连接时,石墨电极产生气泡 |
| C、K与M连接时,一段时间后溶液的pH减小 |
| D、K与M连接时,石墨电极的反应为:2Cl--2e-═Cl2↑ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:K与N连接时,该装置是原电池,铁易失电子作负极,石墨作正极,正极上氢离子放电,负极反应为Fe-2e-=Fe2+,正极反应为2H++2e-=H2↑;
K与M连接时,该装置是电解池,石墨是阳极、铁作阴极,阳极反应为2Cl--2e-=Cl2↑、阴极反应为2H++2e-=H2↑,据此分析解答.
K与M连接时,该装置是电解池,石墨是阳极、铁作阴极,阳极反应为2Cl--2e-=Cl2↑、阴极反应为2H++2e-=H2↑,据此分析解答.
解答:
解:A.K与N连接时,该装置将化学能转化为电能,所以组成原电池装置,故A正确;
B.K与N连接时,石墨电极作正极,电极反应为2H++2e-=H2↑,所以产生气泡,故B正确;
C.K与M连接时,阳极反应为2Cl--2e-=Cl2↑、阴极反应为2H++2e-=H2↑,一段时间后溶液中氢离子浓度减小,则溶液的pH增大,故C错误;
D.K与M连接时,石墨电极为阳极,石墨电极的反应为:2Cl--2e-═Cl2↑,故D正确;
故选C.
B.K与N连接时,石墨电极作正极,电极反应为2H++2e-=H2↑,所以产生气泡,故B正确;
C.K与M连接时,阳极反应为2Cl--2e-=Cl2↑、阴极反应为2H++2e-=H2↑,一段时间后溶液中氢离子浓度减小,则溶液的pH增大,故C错误;
D.K与M连接时,石墨电极为阳极,石墨电极的反应为:2Cl--2e-═Cl2↑,故D正确;
故选C.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,再结合溶液中氢离子浓度变化分析解答,题目难度不大.

练习册系列答案
相关题目
糖类的概念是( )
| A、含有碳、氢、氧三种元素的有机物 |
| B、符合通式Cn(H2O)m的化合物 |
| C、有甜味的物质 |
| D、一般是多羟基醛、多羟基酮以及能水解生成它们的物质 |
CrO5的结构式为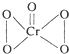 ,据此推断该氧化物( )
,据此推断该氧化物( )
 ,据此推断该氧化物( )
,据此推断该氧化物( )| A、稳定性比较高,不易分解 |
| B、稳定性比较低,易分解 |
| C、分子中所有原子均达到8电子稳定结构 |
| D、属于碱性氧化物 |
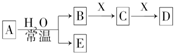 由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )| A、若A是单质,B和D的反应是OH-+HCO3-═H2O+CO32-,则E是一种清洁能源 |
| B、若D为CO,C能和E反应,则A一定为Na2O2 |
| C、若X是Na2CO3,C为含极性键的分子,则A一定是氯气,且D和E能发生反应 |
| D、若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐 |
不用其他试剂无法鉴别的一组溶液是( )
| A、氯化铁溶液和氯化铜溶液 |
| B、盐酸和碳酸氢钠溶液 |
| C、氯化铝溶液和氢氧化钠溶液 |
| D、硫酸溶液和碳酸钠溶液 |
用排空气法收集的氨气烧瓶做喷泉实验后,当水上升到整个烧瓶体积的
,则烧瓶内的氨水的物质量浓度是(按标准状况下计算)( )
| 2 |
| 3 |
| A、0.045mol/L |
| B、0.03mol/L |
| C、1mol/L |
| D、不能确定 |
下列说法不正确的是( )
| A、在医疗上,碳酸氢钠是治疗胃酸过多症的一种药剂 |
| B、工业上生产漂粉精,是通过氯气与石灰水作用制成的 |
| C、高性能通信材料光导纤维的主要原料是二氧化硅 |
| D、空气中的NO2是造成光化学烟雾的主要因素 |
下列有关电解质溶液中微粒浓度关系不正确的是( )
| A、0.1mol?L-1 pH=4的NaHA溶液中:c(HA-)>c(A2-)>c(H2A) |
| B、1mol?L-1的NaHCO3溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=1mol?L-1 |
| C、常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX的混合溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
下列说法正确的是( )
| A、Na2SO3与BaCl2溶液作用,有白色沉淀,加稀硝酸后沉淀消失 |
| B、将SO2气体通入Ba(OH)2溶液中没有白色沉淀生成 |
| C、将SO2气体通过BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入用硝酸酸化的BaCl2溶液中有白色沉淀生成 |