题目内容
(2006?揭阳二模)在某密闭容器中投入X、Y进行如下反应:X(g)+2Y(g) 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )分析:令参加反应的X的物质的量为n,利用三段式法求出平衡时各组分的物质的量,根据平衡时反应物总物质的量与生成物总物质的量相等,用x、y表示出n,再利用可逆反应的不完全性,反应物不能完全反应,列不等式,据此解答.
解答:解:令参加反应的X的物质的量为n,
X(g)+2Y(g)?2Z(g),
开始(mol):x y 0
转化(mol):n 2n 2n
平衡(mol):x-n y-2n 2n
平衡时反应物总物质的量与生成物总物质的量相等,所以有x-n+y-2n=2n,解得n=
;
反应物不能完全反应,所以有
,即
解(1)得:
>
解(2)得:
<
所以
<
<
.
故选D.
X(g)+2Y(g)?2Z(g),
开始(mol):x y 0
转化(mol):n 2n 2n
平衡(mol):x-n y-2n 2n
平衡时反应物总物质的量与生成物总物质的量相等,所以有x-n+y-2n=2n,解得n=
| x+y |
| 5 |
反应物不能完全反应,所以有
|
|
解(1)得:
| x |
| y |
| 1 |
| 4 |
解(2)得:
| x |
| y |
| 3 |
| 2 |
所以
| 1 |
| 4 |
| x |
| y |
| 3 |
| 2 |
故选D.
点评:本题考查化学平衡计算,难度中等,关键在于利用反应物不能完全反应,列不等式.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
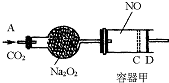 (2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
(2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的