题目内容
(2006?揭阳二模)等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
分析:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,发生:Zn+Cu2+=Zn2++Cu,形成原电池,反应速率增大,但生成的氢气少.
解答:解:等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,
发生:Zn+Cu2+=Zn2++Cu,形成原电池,反应速率增大,反应用时少于b,但生成的氢气少也少于b,图象应为 .
.
故选D.
发生:Zn+Cu2+=Zn2++Cu,形成原电池,反应速率增大,反应用时少于b,但生成的氢气少也少于b,图象应为
 .
.故选D.
点评:本题考查原电池知识,题目难度不大,注意原电池反应较一般化学反应速率更大,注意硫酸过量.

练习册系列答案
相关题目
 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )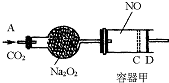 (2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
(2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的