题目内容
(2006?揭阳二模)某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)上述(B)操作的目的是
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)
(4)实验中用左手控制
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是
A.移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B.用标准溶液润洗滴定管2-3次
C.把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
BDCEAF
BDCEAF
.(2)上述(B)操作的目的是
防止将标准液稀释
防止将标准液稀释
.(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)
偏大
偏大
.(4)实验中用左手控制
碱式滴定管橡皮管玻璃珠处
碱式滴定管橡皮管玻璃珠处
(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化
锥形瓶中溶液的颜色变化
,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色
.(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是
偏小
偏小
.(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是
偏大
偏大
.分析:(1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)滴定管在装液时,为了防止溶液被稀释,需用待装液润洗;
(3)根据c(待测)=
分析误差;
(4)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)称取一定量的KOH固体(含少量NaOH),n(OH-)偏大,消耗酸偏大,由c(待测)=
分析误差;
(6)仰视观察滴定管中液面刻度,读数偏大,标准液的体积偏大,根据c(待测)=
分析误差;
(2)滴定管在装液时,为了防止溶液被稀释,需用待装液润洗;
(3)根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(4)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(5)称取一定量的KOH固体(含少量NaOH),n(OH-)偏大,消耗酸偏大,由c(待测)=
| c(标准)×V(标准) |
| V(待测) |
(6)仰视观察滴定管中液面刻度,读数偏大,标准液的体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
解答:解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,
故答案为:BDCEAF;
(2)上述(B)操作的目的是防止将标准液稀释,
故答案为:防止将标准液稀释;
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,待测液的物质的量偏大,则消耗的标准液体积偏大,根据c(待测)=
分析,可知c(待测)偏大;
故答案为:偏大;
(4)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,所以会造成V(标)偏小,根据c(待测)=
分析,可知c(待测)偏小;
故答案为:偏小;
(6)仰视观察滴定管中液面刻度,读数偏大,标准液的体积偏大,根据c(待测)=
分析,可知c(待测)偏大;
故答案为:偏大;
故答案为:BDCEAF;
(2)上述(B)操作的目的是防止将标准液稀释,
故答案为:防止将标准液稀释;
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,待测液的物质的量偏大,则消耗的标准液体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:偏大;
(4)滴定时,滴定过程中,用左手控制碱式滴定管橡皮管玻璃珠处,右手摇动锥形瓶,两眼应该注视锥形瓶内溶液的颜色变化;滴定时,锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色,可说明达到滴定终点;
故答案为:碱式滴定管橡皮管玻璃珠处;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,等质量的NaOH或KOH固体来中和酸时,NaOH消耗的盐酸的多,所以会造成V(标)偏小,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:偏小;
(6)仰视观察滴定管中液面刻度,读数偏大,标准液的体积偏大,根据c(待测)=
| c(标准)×V(标准) |
| V(待测) |
故答案为:偏大;
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的步骤、方法以及注意事项,在误差分析时根据c(待测)=
分析即可.
| c(标准)×V(标准) |
| V(待测) |

练习册系列答案
相关题目
 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量x、y之比应满足( )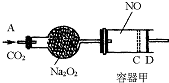 (2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
(2006?揭阳二模)如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的