��Ŀ����
��2006?������ģ����ĩ״����A���ɵ����ʵ�����MgO��Fe2O3��ɵĻ�����������ʵ�飺
��ȡ����A�������ȷ�Ӧ���������е���B���ɣ���
��ȡ20g Aȫ������0.15L 6.0mol/L�����У�����ҺC��
�۽����еõ��ĵ���B����ҺC��Ӧ���ų�1.12L����״�������壬ͬʱ������ҺD���������й�������B��
����KSCN��Һ����ʱ����ҺD����ɫ��
��ش�
��1���ٲ����еĵ���B��
��2�������������ĸ���Ӧ�Ļ�ѧ����ʽ��
��3�������������ĸ���Ӧ�����ӷ���ʽ��
��4������ҺD���������Ϊ0.15L�������Һ��c��Mg2+��Ϊ
��ȡ����A�������ȷ�Ӧ���������е���B���ɣ���
��ȡ20g Aȫ������0.15L 6.0mol/L�����У�����ҺC��
�۽����еõ��ĵ���B����ҺC��Ӧ���ų�1.12L����״�������壬ͬʱ������ҺD���������й�������B��
����KSCN��Һ����ʱ����ҺD����ɫ��
��ش�
��1���ٲ����еĵ���B��
Fe
Fe
����2�������������ĸ���Ӧ�Ļ�ѧ����ʽ��
MgO+2HCl=MgCl2+H2O��Fe2O3+6HCl=2FeCl3+3H2O
MgO+2HCl=MgCl2+H2O��Fe2O3+6HCl=2FeCl3+3H2O
����3�������������ĸ���Ӧ�����ӷ���ʽ��
Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+
Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+
����4������ҺD���������Ϊ0.15L�������Һ��c��Mg2+��Ϊ
0.67mol/L
0.67mol/L
��c��Fe2+��Ϊ2.33mol/L
2.33mol/L
����������1�����ȷ�Ӧ�������û���Ӧ��������Mg��Al��Fe�����Է���Al��Fe2O3��Ӧ���û�������
��2��MgO�����ᷴӦ�����Ȼ�þ��ˮ��Fe2O3�����ᷴӦ�����Ȼ�����ˮ��
��3���ų�1.12L����״�������壬˵��������������ҺCΪ�Ȼ������Ȼ�þ������Ļ����Һ��Fe����ҺC��ӦΪ��Fe�����ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ�������
��4����MgO��Fe2O3�����ʵ����ֱ�Ϊxmol�����ݶ�����������x��ֵ����ҺDΪ�Ȼ�þ���Ȼ������Ļ����Һ������þԪ���غ��֪��n��Mg2+��=n��MgO�����ٸ���c=
����þ����Ũ�ȣ����ݵ���غ���Һ��2c��Mg2+��+2c��Fe2+��=c��Cl-�����ݴ˼�����������Ũ�ȣ�
��2��MgO�����ᷴӦ�����Ȼ�þ��ˮ��Fe2O3�����ᷴӦ�����Ȼ�����ˮ��
��3���ų�1.12L����״�������壬˵��������������ҺCΪ�Ȼ������Ȼ�þ������Ļ����Һ��Fe����ҺC��ӦΪ��Fe�����ᷴӦ�����Ȼ������������������Ȼ�����Ӧ�����Ȼ�������
��4����MgO��Fe2O3�����ʵ����ֱ�Ϊxmol�����ݶ�����������x��ֵ����ҺDΪ�Ȼ�þ���Ȼ������Ļ����Һ������þԪ���غ��֪��n��Mg2+��=n��MgO�����ٸ���c=
| n |
| V |
����⣺��1��MgO��Fe2O3��ɵĻ���������ȷ�Ӧ������Al��Fe2O3��Ӧ���û��������ʴ�Ϊ��Fe��
��2��MgO�����ᷴӦ�����Ȼ�þ��ˮ����Ӧ����ʽΪMgO+2HCl=MgCl2+H2O��Fe2O3�����ᷴӦ�����Ȼ�����ˮ����Ӧ����ʽΪFe2O3+6HCl=2FeCl3+3H2O��
�ʴ�Ϊ��MgO+2HCl=MgCl2+H2O��Fe2O3+6HCl=2FeCl3+3H2O��
��3���ų�1.12L����״�������壬˵��������������ҺCΪ�Ȼ������Ȼ�þ������Ļ����Һ��Fe����ҺC��ӦΪ��Fe�����ᷴӦ�����Ȼ���������������Ӧ���ӷ���ʽΪ Fe+2H+=Fe2++H2���������Ȼ�����Ӧ�����Ȼ���������Ӧ���ӷ���ʽΪFe+2Fe3+=3Fe2+��
�ʴ�Ϊ��Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+��
��4����MgO��Fe2O3�����ʵ����ֱ�Ϊxmol����40x+160x=20�����x=0.1����ҺDΪ�Ȼ�þ���Ȼ������Ļ����Һ������þԪ���غ��֪��n��Mg2+��=n��MgO��=0.1mol������c��Mg2+��=
=0.67mol/L�����ݵ���غ���Һ��2c��Mg2+��+2c��Fe2+��=c��Cl-��������2��0.67mol/L+2c��Fe2+��=6mol/L�����c��Fe2+��=2.33mol/L��
�ʴ�Ϊ��0.67mol/L��2.33mol/L��
��2��MgO�����ᷴӦ�����Ȼ�þ��ˮ����Ӧ����ʽΪMgO+2HCl=MgCl2+H2O��Fe2O3�����ᷴӦ�����Ȼ�����ˮ����Ӧ����ʽΪFe2O3+6HCl=2FeCl3+3H2O��
�ʴ�Ϊ��MgO+2HCl=MgCl2+H2O��Fe2O3+6HCl=2FeCl3+3H2O��
��3���ų�1.12L����״�������壬˵��������������ҺCΪ�Ȼ������Ȼ�þ������Ļ����Һ��Fe����ҺC��ӦΪ��Fe�����ᷴӦ�����Ȼ���������������Ӧ���ӷ���ʽΪ Fe+2H+=Fe2++H2���������Ȼ�����Ӧ�����Ȼ���������Ӧ���ӷ���ʽΪFe+2Fe3+=3Fe2+��
�ʴ�Ϊ��Fe+2H+=Fe2++H2����Fe+2Fe3+=3Fe2+��
��4����MgO��Fe2O3�����ʵ����ֱ�Ϊxmol����40x+160x=20�����x=0.1����ҺDΪ�Ȼ�þ���Ȼ������Ļ����Һ������þԪ���غ��֪��n��Mg2+��=n��MgO��=0.1mol������c��Mg2+��=
| 0.1mol |
| 0.15L |
�ʴ�Ϊ��0.67mol/L��2.33mol/L��
���������⿼�鳣�û�ѧ������ʵ���Ũ�ȼ���ȣ��Ѷ��еȣ������Ӧ�����ǽ���Ĺؼ���ע�⣨4�����õ���غ����ȹ��̷�Ҫ��

��ϰ��ϵ�д�
 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
�����Ŀ
 2Z��g������Ҫʹƽ��ʱ��Ӧ�������ʵ����������������ʵ�����ȣ���X��Y�ij�ʼ���ʵ���x��y֮��Ӧ���㣨������
2Z��g������Ҫʹƽ��ʱ��Ӧ�������ʵ����������������ʵ�����ȣ���X��Y�ij�ʼ���ʵ���x��y֮��Ӧ���㣨������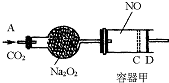 ��2006?������ģ����ͼװ���У��������ڳ���0.1mol NO���壬�������װ��һ����Na2O2����A������ͨ��CO2���壮�����£��������л���������D�����ƶ���������C��ʱ���������С����С��Ϊԭ�����
��2006?������ģ����ͼװ���У��������ڳ���0.1mol NO���壬�������װ��һ����Na2O2����A������ͨ��CO2���壮�����£��������л���������D�����ƶ���������C��ʱ���������С����С��Ϊԭ�����