题目内容
(12分)有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
元素编号 | 特征信息 |
A | 其中一种原子核内只有质子没有中子 |
B | 其原子的L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
E | 单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。
(每空2分)
⑴离子键、(极性)共价键;⑵2Na2O2+2H2O=4NaOH+O2↑(NaH+H2O=NaOH+H2↑)
⑶2Al+2OH-+2H2O=2AlO2-+3H2↑;⑷MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑸Na 金属钠可以和冷水剧烈反应 铝不可以(其他合理答案也可)。
【解析】
试题分析:A的一种原子核内只有质子没有中子,则A为H元素;B原子的L层电子数是K层的3倍,则B为O元素;C阳离子与B的阴离子具有相同的电子层结构,且核电荷数与B相差3,则C为Na元素;D原子的最外层电子数等于电子层数,且是地壳中含量较多的元素之一,则D为Al元素;E单质为黄绿色气体,可用于制造漂白粉,则E为Cl元素。
(1)由A、B、C三种元素形成的化合物为NaOH,含有的化学键类型是:离子键、(极性)共价键。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的反应为:Na2O2与H2O反应生成NaOH和O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,或NaH与H2O反应生成NaOH和H2,化学方程式为:NaH+H2O=NaOH+H2↑。
(3)D单质为Al,A、B、C三种元素形成的化合物为NaOH,Al与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑。
(4)MnO2与浓盐酸反应生成MnCl2、Cl2、H2O,化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(5)C元素形成的单质为金属Na,D元素形成的单质为金属Al,金属钠可以和冷水剧烈反应 铝不可以,活泼性较强的单质是Na。
考点:本题考查元素的推断、物质的性质与制备、方程式的书写、化学键的判断。

(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
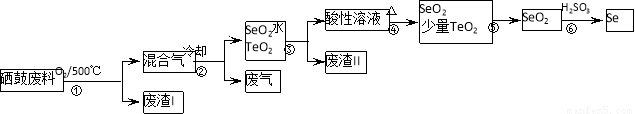
已知:
物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。