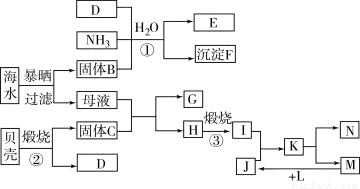
题目内容
某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子 mol B.n=
mol B.n=
C.溶液中H+增加 mol D.n=
mol D.n=
D
【解析】
试题分析:A、R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极上电极反应式为:4OH--4e-=2H2O+O2↑,当产生气体V L(标准状况)时电路中通过电子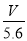 mol,正确;B、R的硝酸盐R(NO3)n溶液用Pt电极电解,电极反应式为R n++ne-=R,根据电子守恒代入数据计算得n=
mol,正确;B、R的硝酸盐R(NO3)n溶液用Pt电极电解,电极反应式为R n++ne-=R,根据电子守恒代入数据计算得n=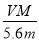 ,正确;C、根据题意知,阴极上氢离子的增加量和阳极上氢氧根离子的减小量是相等的,根据A的分析,溶液中H+增加
,正确;C、根据题意知,阴极上氢离子的增加量和阳极上氢氧根离子的减小量是相等的,根据A的分析,溶液中H+增加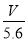 mol,正确;D、R的硝酸盐R(NO3)n溶液用Pt电极电解,电极反应式为R n++ne-=R,根据电子守恒代入数据计算得n=
mol,正确;D、R的硝酸盐R(NO3)n溶液用Pt电极电解,电极反应式为R n++ne-=R,根据电子守恒代入数据计算得n=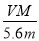 ,错误。
,错误。
考点:考查电解原理的计算。

 名校课堂系列答案
名校课堂系列答案(12分)有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
元素编号 | 特征信息 |
A | 其中一种原子核内只有质子没有中子 |
B | 其原子的L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
E | 单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。