��Ŀ����
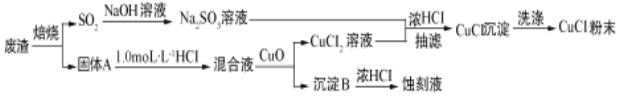
����Ŀ������Ȥ�о�С���ù�ҵ��������Ҫ�ɷ�ΪCu2S��Fe2O3����ȡ�Ȼ���ͭ��ͬʱ���ɵ�·��ʴ��Һ��������ʾ���Ȼ���ͭ����ѧʽΪCuCl���������л��ϳɹ�ҵ�еĴ�����ͨ����һ�ְ�ɫ��ĩ������ˮ���������Ҵ����ڳ�ʪ��������ˮ����������ɫ��������ֽ⡣
��������������£�
�ݴ����̺�������Ϣ�ش��������⣺
��1����֤�������������SO2�ķ���______________________________________���ܽ����A��Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
��2��SO2������NaOH��Һ��Ϊ�õ�������Na2SO3��Һ�������ӦΪ_____________________________________________________________________��
��3����Na2SO3��ˮ��Һ����μ���CuCl2��Һ���ټ�������Ũ������ȣ������Һ�����˼���CuCl������д���÷�Ӧ�����ӷ���ʽ______��
��4��CuCl������ϴ����Ҫ������ϴ��ˮϴ�ʹ�ϴ��ˮϴ����Ϊ____________________����ϴ����ʡ�ԣ�ԭ����______��
��5���õ�CuCl����ҪѸ����ո����ȴ���ܷ��װ������������Ŀ����_______________________________________________________��
��6���Ȼ���ͭ����ˮ��Ѹ����ˮ��Ӧ����ש��ɫ���壬д���÷�Ӧ�Ļ�ѧ����ʽ_________________��
���𰸡� ������ͨ��Ʒ����Һ����Һ��ɫ�����Ⱥ��ָֻ���ɫ CuO+2HCl=CuCl2+H2O ��Fe2O3+6HCl=2FeCl3+3H2O ��NaOH��Һ���ȷ֣�һ��ͨ������SO2����Һ�ȣ�Ȼ������һ��NaOH��Һ��ϣ����õ�������Һ 2Cu2++SO32��+2Cl��+H2O=2CuCl��+SO42��+2H+ ��������м�������ˮ����û���壬��ˮ�˳������ظ�����2-3�� ��ϴ�����ڼӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ Ϊ���������ʣ���Ϊ�Ȼ���ͭ�ڿ����л�Ѹ�ٱ�������������ֽ� 2CuCl+H2O ![]() Cu2O��+2HCl
Cu2O��+2HCl
���������ù�ҵ��������Ҫ�ɷ�ΪCu2S��Fe2O3����ȡ�Ȼ���ͭ��ͬʱ���ɵ�·��ʴ��Һ��������������ͭ��������ͭ����������������ͨ������������Һ���յõ�����������Һ������A��ҪΪ����ͭ��������������ϡ�����ܽ�õ��Ȼ�����Һ���Ȼ�ͭ��Һ����������ͭ������ҺPHʹ������ȫ�����������˵õ��Ȼ�ͭ��Һ�ͳ���B������BΪ�������������������ܽ���Ũ����õ�ʴ��Һ������������Һ���Ȼ�ͭ��Һ����Ũ������˵õ��Ȼ���ͭ������ϴ�ӵõ������ĩ����1����֤������SO2�����ǽ�����ͨ��Ʒ����Һ����Һ��ɫ�����Ⱥ��ָֻ���ɫ������A������ͭ������������Ӧ���ɵ�����ͭCuO��ԭ�����е�������Fe2O3�Ļ��������������ܽ�ʱ��Ӧ����ʽΪ��CuO+2HCl=CuCl2+H2O Fe2O3+6HCl=2FeCl3+3H2O����2��SO2��NaOH��Ӧ����SO2��������NaOHʣ�࣬SO2����������NaHSO3�ˣ�Ϊ�õ�������Na2SO3��Һ�������ӦΪ��NaOH��Һ���ȷ֣�һ��ͨ������SO2����Һ�ȣ�Ȼ������һ��NaOH��Һ��ϣ����õ�������Һ����3����Na2SO3��ˮ��Һ����μ���CuCl2��ˮ��Һ�У��ټ�������Ũ������ȣ������Һ�����˼���CuCl��������Ӧ�����ӷ���ʽΪ��2Cu2++SO32��+2Cl��+H2O=2CuCl��+SO42��+2H������4��ˮϴ����Ϊ����������м�������ˮ����û���壬��ˮ�˳������ظ�����2-3�Ρ���ϴ�����ڼӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ����������5���õ�CuCl����ҪѸ����ո����ȴ���ܷ��װ������������Ŀ����Ϊ���������ʣ���Ϊ�Ȼ���ͭ�ڿ����л�Ѹ�ٱ�������������ֽ⣻��6���Ȼ���ͭ����ˮ��Ѹ����ˮ��Ӧ����ש��ɫ����Ϊ������ͭ�����ԭ���غ���ƽ��д��ѧ����ʽΪ��2CuCl+H2O![]() Cu2O��+2HCl��
Cu2O��+2HCl��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����(As)����Ϊ�뵼�������(Ge)��IJ���Ԫ�أ���Щ���Ϲ㷺Ӧ���ڷ�������ܡ������߷������ȡ��ش��������⣺
(1)��Ȼ��SiO2������̬�нᾧ�κ����������࣬�ᾧ��SiO2���Է��ij��ֹ�����������ε����ʱ���Ϊ�����______________�ԣ�������������̬��SiO2��ɿ��ķ�����Թ������___________ʵ�顣
(2)��̬��ԭ�ӵļ۲�����Ų�ͼΪ_____________������ܲ����Ϊ_____________��Ge��As��Se��һ�����ܴӴ�С��˳��Ϊ_____________________��
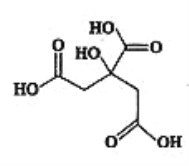
(3)��Ԫ����̼Ԫ�����ƣ����γ�����(GenH2n+2)��������û�з���n����5�����飬�����±��ṩ�����ݷ������е�ԭ��_____________________��
��ѧ�� | C-C | C-H | Ge-Ge | Ge-H |
����(kJ��mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4�����еļ���Ϊ_____________��GeH4������Ge��_____________�����H��_________����ص��γɦҼ���
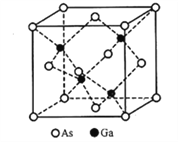
(5)�����黯�صľ�������ͼ��ʾ����֪�����߳�Ϊ565pm����Ga-As���ļ���Ϊ___________pm(ֻ�г���ʽ����)��Ga-As���й��õ��Ӷ�ƫ��____________(�Ga����As��)��