题目内容
【题目】2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,是工业制硫酸的主要反应之一。
2SO3(g) ΔH<0,是工业制硫酸的主要反应之一。
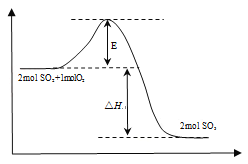
(1)该反应过程的能量变化如右图所示:E的大小对该反应的反应热有无影响_______(填“有”或“无”),该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_______。
A.△H B.E C.△H – E D.△H + E
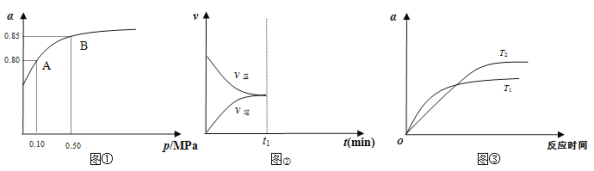
(2)某温度下,甲同学将2 mol SO2和1 mol O2置于密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图①所示,若A点二氧化硫的平衡浓度为0.04 mol/L,则容器的体积为_______L;图①中B点SO2、O2、SO3的平衡浓度之比为________________;反应到达平衡时,时间t1时缩小容器体积,请在图②中画出时间t1之后反应速率变化图像;图③为压强等于0.50 MPa时不同温度下SO2转化率与温度关系图,图中T2_____T1(填写“大于”或“小于”)
(3)在2 L的密闭容器中,乙同学投入2 mol SO2和b mol O2,25 min时达到平衡,如下图所示,在35 min时,改变某一条件,经过一段时间后,70 min时,反应再次达到平衡,回答下列问题:
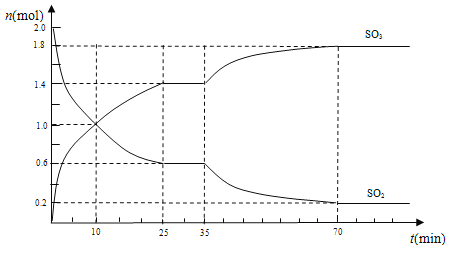
①10 min时,v(SO2)正________v(SO3)逆(填“>”“<”或“=”)
②求0~10 min时,v(O2)=______________
③反应开始至35 min时,测得反应共放热138.6 kJ,则反应2SO2(g)+O2(g)![]() 2SO3(g)△H=____kJ/mol
2SO3(g)△H=____kJ/mol
④35 min时,改变的条件可能是___________________
a.加入更多的V2O5
b.从容器中分离出少量O2
c.投入一定量的SO3
d.降低反应温度
e.往容器中加入N2,使容器压强增大
【答案】(1)无 B (2)10 6:3:34 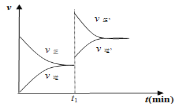 小于
小于
(3)①> ②0.025 mol/(L·min) ③ -198.0 ④d
【解析】
试题分析:(1)E表示反应的活化能,活化能的大小与反应热大小无关系;催化剂能降低反应的活化能,所以加入V2O5催化剂后,改变的是图中E,答案选B。
(2)二氧化硫起始浓度为2mol÷V=2/V mol/L,由甲图可知A点SO2的转化率为0.8,所以△c(SO2)=0.8×2/Vmol/L=1.6/V mol/L,二氧化硫的平衡浓度为2/V mol/L-1.6/Vmol/L=0.04mol/L,解得V=10L;由图①可知B点SO2的转化率为0.85,所以△c(SO2)=0.85×0.2mol/L=0.17mol/L,则:
2SO2(g)+O2(g) 2SO3(g)
开始(mol/L):0.2 0.1 0
变化(mol/L):0.17 0.085 0.17
平衡(mol/L):0.03 0.015 0.17
所以B点SO2、O2、SO3的平衡浓度之比为0.03:0.015:0.17=6:3:34。
达平衡后,缩小容器容积,反应混合物的浓度都增大,正、逆反应速率都增大,体系压强增大,平衡向体积减小的反应移动,即平衡向正反应移动,V(正)>V(逆),化学图像为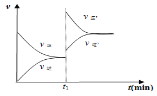 ;由到达平衡的时间可知,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快,所以T2<T1。
;由到达平衡的时间可知,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快,所以T2<T1。
(3)①根据图像可知,10 min过后,SO3的物质的量仍然增加,说明反应向正反应方向进行,则在10min时,v(SO2)正>v(SO3)逆。
②0~10 min时,SO3生成了1mol,则v(SO3)=1mol÷(2L×10min)= 0.05 mol/(L·min),根据化学反应速率之比等于化学计量数之比,v(O2)=1/2v(SO3)= 0.025 mol/(L·min)。
③反应开始至35 min时,反应生成1.4molSO3,测得反应共放热138.6 kJ,则生成2molSO3时,放热为138÷1.4×2=198.0kJ,所以反应2SO2(g)+O2(g)![]() 2SO3(g)△H=-198.0kJ/mol。
2SO3(g)△H=-198.0kJ/mol。
④35 min时,a.加入更多的V2O5,催化剂只能加快化学反应速率,不能改变平衡,SO2、SO3的物质的量不变,与图像不符,错误;b.从容器中分离出少量O2 ,平衡逆向移动,SO3的物质的量减少,与图像不符,错误;c.投入一定量的SO3,SO3的物质的量会突然猛增,与图像不符,错误;d.降低反应温度,平衡正向移动,与图像相符,正确;e.往容器中加入N2,使容器压强增大,但各成分浓度不变,平衡不移动,与图像不符,错误;所以改变的条件可能是d。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:[
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是: ,碱性最强的化合物的电子式是: 。
(2)最高价氧化物是两性氧化物的元素是 ;写出它的氧化物与氢氧化钠反应的离子方程式 。
(3)用电子式表示元素④与⑥的化合物的形成过程: 。
(4)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_______(要求用离子符号表示)。
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为: 。