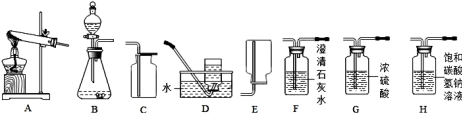
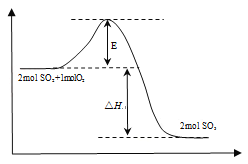
题目内容
【题目】向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸。下列离子方程式与事实不相符的是 ( )
A.OH-+CO32-+2H+![]() HCO3-+H2O
HCO3-+H2O
B.2OH-+CO32-+3H+![]() HCO3-+2H2O
HCO3-+2H2O
C.2OH-+CO32-+4H+![]() CO2↑+3H2O
CO2↑+3H2O
D.OH-+CO32-+3H+![]() CO2↑+2H2O
CO2↑+2H2O
【答案】C
【解析】
试题分析:向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,首先是氢氧化钠和盐酸反应,当氢氧化钠反应完,盐酸还有剩余的时候,盐酸再和碳酸根反应生成碳酸氢根,盐酸再有剩余时才和碳酸氢根反应生成水和二氧化碳,A.当氢氧化钠、碳酸钠、盐酸的物质的量之比为1:1:2时,发生反应OH-+CO32-+2H+![]() HCO3-+H2O,A正确;B.当氢氧化钠、碳酸钠、盐酸的物质的量之比为2:2:3时,发生反应2OH-+CO32-+3H+
HCO3-+H2O,A正确;B.当氢氧化钠、碳酸钠、盐酸的物质的量之比为2:2:3时,发生反应2OH-+CO32-+3H+![]() HCO3-+2H2O,B正确;C. 2OH-+CO32-+4H+
HCO3-+2H2O,B正确;C. 2OH-+CO32-+4H+![]() CO2↑+3H2O该反应不可能发生,只可能得到碳酸氢根,C错误;D.当氢氧化钠、碳酸钠、盐酸的物质的量之比为1:1:3时OH-+CO32-+3H+
CO2↑+3H2O该反应不可能发生,只可能得到碳酸氢根,C错误;D.当氢氧化钠、碳酸钠、盐酸的物质的量之比为1:1:3时OH-+CO32-+3H+![]() CO2↑+2H2O,D正确,答案选C。
CO2↑+2H2O,D正确,答案选C。

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案
相关题目