题目内容
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.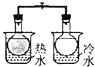 将NO2球浸泡在冷水和热水中
将NO2球浸泡在冷水和热水中
B.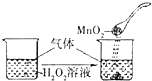 向H2O2溶液中滴加MnO2粉末
向H2O2溶液中滴加MnO2粉末
C.
T(℃) | 25 | 50 | 100 |
水的离子积常数KW(×10﹣14) | 1.01 | 5.47 | 55.0 |
D.
c(氨水)/mol.L﹣1 | 0.1 | 0.01 |
pH | 11.1 | 10.6 |
【答案】B
【解析】解:A.存在平衡2NO2N2O4 , 且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A错误;B.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故B正确;
C.水是弱电解质,存在电离平衡H2OH++OH﹣ , 电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故C错误;
D.氨水中存在平衡NH3H2ONH4++OH﹣ , 浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,故D错误;
故选B.
【考点精析】关于本题考查的化学平衡移动原理以及影响因素,需要了解影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动才能得出正确答案.

练习册系列答案
相关题目