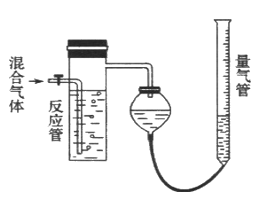
题目内容
【题目】电浮选凝聚法处理酸性污水的工作原理如图所示.下列说法不正确的是( )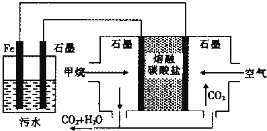
A.铁电极的电极反应式为:Fe-2e-═Fe2+
B.通人空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO![]()
C.若左池石墨电极产生44.8L(标准状况)气体,则消耗氧气0.5mol
D.为增强污水的导电能力,可向污水中加入适量工业用食盐
【答案】C
【解析】A.通入氧气的电极上得电子发生还原反应,所以通入氧气的电极为正极,则铁作阳极,阳极上铁失电子发生氧化反应,电极反应式为Fe-2e-═Fe2+ , 故A正确;B.通入空气的电极为正极,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-═2CO![]() ,故B正确;C.石墨电极上析出的气体为氢气,生成44.8L氢气转移电子的物质的量
,故B正确;C.石墨电极上析出的气体为氢气,生成44.8L氢气转移电子的物质的量 ![]() = ×2=4mol,根据转移电子相等得,消耗氧气的物质的量
= ×2=4mol,根据转移电子相等得,消耗氧气的物质的量 ![]() = =1mol,故C错误;D.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故D正确;
= =1mol,故C错误;D.水是弱电解质,其导电能力较小,为了增强溶液的导电能力而加入强电解质,故D正确;

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.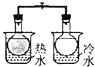 将NO2球浸泡在冷水和热水中
将NO2球浸泡在冷水和热水中
B.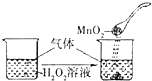 向H2O2溶液中滴加MnO2粉末
向H2O2溶液中滴加MnO2粉末
C.
T(℃) | 25 | 50 | 100 |
水的离子积常数KW(×10﹣14) | 1.01 | 5.47 | 55.0 |
D.
c(氨水)/mol.L﹣1 | 0.1 | 0.01 |
pH | 11.1 | 10.6 |