题目内容
【题目】短周期主族元素X,Y,Z,W的原子序数依次增大,四种元素同周期,X的金属性再同周期元素中最强,Y原子的电子层数与最外层电子数相等;Z元素在地壳中的含量居于第二位,W的最高价氧化物的水化物的化学式为HnWO2n+2 , 下列说法正确的是( )
A.简单离子半径:X<Y<W
B.Y,Z两种元素的氧化物均具有两性
C.X,W分别形成的氢化物中所含化学键种类相同
D.Z,W形成化合物的电子式为 ![]()
【答案】D
【解析】解:短周期主族元素X、Y、Z、W的原子序数依次增大,Z元素在地壳中的含量居于第二位,则Z为Si元素;四种元素同周期,X的金属性在同周期元素中最强,则X为Na元素;Y原子的电子层数与最外层电子数相等,则Y最外层含有3个电子,为Al元素;W的最高价氧化物的水化物的化学式为HnWO2n+2 , 设W的最高正化合价为x,则x+n=4n+4,则x=3n+4,n只能为1,即其最高正化合价为+7,故W为Cl元素,A.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径大小:Y<X<W,故A错误;
B.Y的氧化物为氧化铝,Z的氧化物为二氧化硅,氧化铝具有两性,而二氧化硅为酸性氧化物,故B错误;
C.X的氢化物为NaH,W的氢化物为HCl,NaH含有离子键,而HCl中含有共价键,故C错误;
D.Z、W形成化合物为四氯化碳,四氯化碳的电子式为 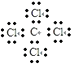 ,故D正确;
,故D正确;
故选D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.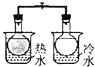 将NO2球浸泡在冷水和热水中
将NO2球浸泡在冷水和热水中
B.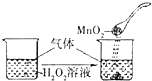 向H2O2溶液中滴加MnO2粉末
向H2O2溶液中滴加MnO2粉末
C.
T(℃) | 25 | 50 | 100 |
水的离子积常数KW(×10﹣14) | 1.01 | 5.47 | 55.0 |
D.
c(氨水)/mol.L﹣1 | 0.1 | 0.01 |
pH | 11.1 | 10.6 |



